cho 21,6 gam hỗn hợp gồm Fe và Fe2O3 tác dụng hết với axit H2SO4 đặc , nóng thu được 3,36 lít khí SO2 duy nhất (điều kiện tiêu chuẩn) . khối lượng của Fe và Fe2O3 trong hỗn hợp lần lượt là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{O_2}=15.04-11.2=3.85\left(g\right)\)
\(n_{O_2}=\dfrac{3.85}{32}=0.1203125\left(mol\right)\)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
Bảo toàn e :
\(n_{SO_2}=\dfrac{3\cdot0.2-0.1203125\cdot4}{2}=0.059375\left(mol\right)\)
\(V_{SO_2}=1.33\left(l\right)\)

nSO2 = 3.36/22.4 = 0.15 (mol)
2Fe + 6H2SO4(đ) => Fe2(SO4)3 + 3SO2 + 6H2O
0.1...............................0.05.............0.15
mFe2O3 = 21.6 - 0.1*56 = 16 (g)
nFe2O3 = 16/160 = 0.1 (mol)
Fe2O3 + 3H2SO4 => Fe2(SO4)3 + 3H2O
0.1...................................0.1
mFe2(SO4)3 = ( 0.1 + 0.05) * 400 = 60 (g)

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
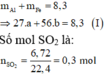
Sơ đồ phản ứng:
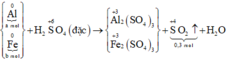
Các quá trình nhường, nhận electron:


\(PTHH:\\ Fe+2HCl\to FeCl_2+H_2\\ Fe_2O_3+6HCl\to 2FeCl_3+3H_2O\\ n_{H_2}=\dfrac{1,12}{22,4}=0,05(mol)\\ \Rightarrow n_{Fe}=0,05(mol)\\ \Rightarrow m_{Fe}=0,05.56=2,8(g)\\ \Rightarrow m_{Fe_2O_3}=10,8-2,8=8(g)\)
Chọn B
Có thời gian đăng video lên Youtube mà không có thời gian rep :'v



Đáp án B
Xét giai đoạn A tác dụng với H2SO4 đặc, nóng, dư:
Số mol SO2 thu được là: n SO 2 = 0 , 15 mol
Qui đổi hỗn hợp A thành Fe : a mol; O : b mol
![]()
Sơ đồ phản ứng :
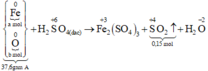
Các quá trình nhường, nhận electron:
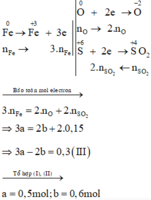
Xét giai đoạn để m gam Fe ngoài không khí:
Sơ đồ phản ứng :



Gọi nFe= a mol nFe2O3=b mol
mhh chất rắn ban đầu=56a+160b=21,6(1)
nSO2=3,36/22,4=0,15 mol
2Fe +6H2SO4 =>Fe2(SO4)3 +3SO2 +6H2O
0,1 mol<= 0,15 mol
=>a=0,1 mol Thay vào (1) có b=0,1
mFe=0,1.56=5,6g
mFe2O3=16g