Hỗn hợp Z gồm 1 hidrocacbon A(ở thể khí đk thường) và Oxi(lượng oxi trong Z gấp đôi lượng oxi cần thiết để đốt cháy A). Bật tia lửa điện để đốt cháy hh Z, đến khi kết thúc pư thì V khí và hơi sau khi đốt k đổi so với ban đầu.
CTPT A?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

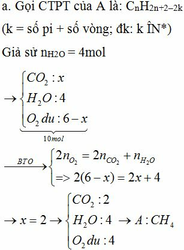
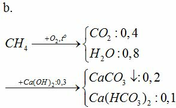
pt:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,3 → 0,3 0,3
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,1 → 0,1 0,1
m dd tăng = mCO2 + mH2O – mCaCO3 = 12g

Gọi CTHH của Z là $C_nH_{2n-2}O_4$ ( Coi là 1 mol)
Ta có :
Bảo toàn e : $n_{O_2} = \dfrac{4n + 2n-2 -2.4}{4} = \dfrac{6n-10}{4}$
Bảo toàn C : $n_{CO_2} = n$
Suy ra: $\dfrac{6n-10}{4} = n \Rightarrow n = 5$
Mặt khác :
Gọi $n_{C_5H_8O_4} = a(mol)$
Suy ra: $n_{CO_2} = 5a ; n_{H_2O} = 4a$
Ta có: $5a.44 + 4a.18 = 43,8 \Rightarrow a = 0,15$
$\Rightarrow m = 0,15.132 = 19,8(gam)$

Đáp án B
Từ dB/H2 = 19 tính được nO2 : nO3 = 5 : 3
Giả sử nA =3; nB = 6,4 → nO2 = 4; nO3 = 2,4; → nO = 4.2+2,4.3=15,2
Đặt CTC 3 hidrocacbon là CxHy
CxHy + (2x+y/2)O → xCO2 + y/2H2O
Ta có 2x/y = 2,6/2,4 và 2x + y/2 = 15,2/3 → x = 26/15; y = 3,2
MA = 12.26/15 + 3,2 = 24; dA/H2 =12

Gọi số mol CH4, O2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{16a+32b}{a+b}=14,4.2=28,8\left(g/mol\right)\)
=> 12,8a = 3,2b
=> a : b = 1 : 4
Giả sử A gồm 1 mol CH4 và 4 mol O2
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{1}{1}< \dfrac{4}{2}\) => CH4 hết, O2 dư
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
1---->2----------->1
=> \(B\left\{{}\begin{matrix}CO_2:1\left(mol\right)\\O_{2\left(dư\right)}=4-2=2\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_B=\dfrac{1.44+2.32}{1+2}=36\left(g/mol\right)\)
=> \(d_{B/A}=\dfrac{36}{28,8}=1,25\)

Vì: %mCH4 = 80%
\(\Rightarrow m_{CH_4}=25.80\%=20\left(g\right)\Rightarrow n_{CH_4}=\dfrac{20}{16}=1,25\left(mol\right)\)
\(\Rightarrow m_{H_2}=5\left(g\right)\Rightarrow n_{H_2}=\dfrac{5}{2}=2,5\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Theo PT: \(\Sigma n_{O_2}=\dfrac{1}{2}n_{H_2}+2n_{CH_4}=3,75\left(mol\right)\)
\(\Rightarrow V_{O_2}=3,75.22,4=84\left(l\right)\)
Mà: %VO2 = 20%
\(\Rightarrow V_{kk}=\dfrac{84}{20\%}=420\left(l\right)\)
Bạn tham khảo nhé!

Bài 1 :
\(n_{Na}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(4Na+O_2\rightarrow2Na_2O\)
..0,1....0,025....0,05.......
a, \(V_{O_2}=n.22,4=0,56\left(l\right)\)
b, \(m=m_{Na_2o}=n.M=3,1\left(g\right)\)
Bài 2 :
\(n_{Al}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(4Al+3O_2\rightarrow2Al_2O_3\)
..0,1...0,075...
\(\Rightarrow n_{O_2}=0,075\left(mol\right)\)
Mà : \(\Sigma n_{O_2}=\dfrac{V}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow n_{O_2\left(Mg\right)}=0,4-0,075=0,325\left(mol\right)\)
\(2Mg+O_2\rightarrow2MgO\)
.0,65.....0,325........
\(\Rightarrow m_{Mg}=15,6\left(g\right)\)
\(\Rightarrow m_{hh}=2,7+15,6=18,3\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%Al=~14,75\\\%Mg=~85,25\end{matrix}\right.\) %
Bài 3 :
- Gọi số mol Al và Mg lần lượt là x , y
\(4Al+3O_2\rightarrow2Al_2O_3\)
..x....0,75x
\(2Mg+O_2\rightarrow2MgO\)
..y........0,5y...........
Có : \(n_{O_2}=0,75x+0,5y=\dfrac{V}{22,4}=0,1\left(mol\right)\left(I\right)\)
Lại có : \(m_{hh}=m_{Al}+m_{Mg}=27x+24y=3,9\left(II\right)\)
- Giair ( i ) và ( ii ) ta được : \(\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\) ( mol )
\(\Rightarrow\left\{{}\begin{matrix}\%Al=~69,23\\\%Mg=~30,77\end{matrix}\right.\) %
Vậy ...
nhưng giữ kiện đè bài cho có cái 40% đâu