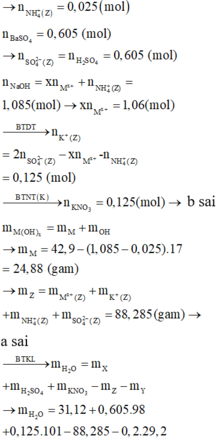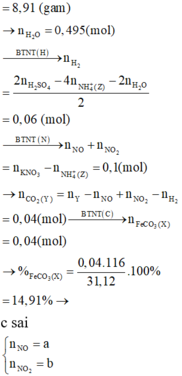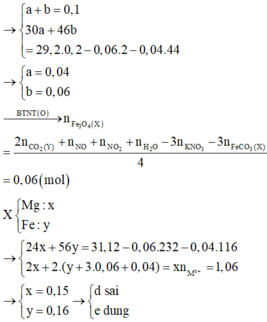cho 17.7 gam hỗn hợp Fe,Zn vào dung dịch H2SO4 loãng thấy thoát ra 4,48 lít khí H2. Cho NaOH dư vào dung dịch sau phản ứng thấy xuất hiện 9 gam kết tủa. Tính khối lượng trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Từ (1), (2) và (3)
=> a = 0,28 (mol) ; b = 0,04 (mol) ; x = 0,06 (mol
=> m = 24,88 + 39 ( 0,255 –b –x) + 0,025.18 + 0,605.96 = 88, 285 => nhận định a) sai
nKNO3 = 0,225 – b – x = 0,125 => nhận định b) sai
%FeCO3 = ( 0,04.116/ 31,12).100% = 14,91% => nhận định c) sai
nO = 4nFe3O4 + nFeCO3 => nFe3O4 = 0,06 => nhận định d) sai
=> có tất cả 4 nhận định sai.

Chọn đáp án D
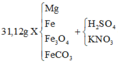
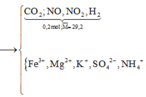
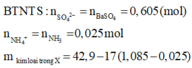 = 24,88 gam
= 24,88 gam
Quy đổi hỗn hợp X thành Fe, Mg, O và CO2
Đặt a, b là số mol của O và CO2 trong X. Đặt x là số mol H2
∑ m(O +CO2) = 31,12 – 24,88 = 6,24 (1)
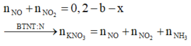
= 0,255 - b - x
Sau phản ứng với dung dịch NaOH thu được dd chứa K2SO4 và Na2SO4
Bảo toàn điện tích:

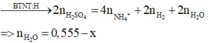
![]()
![]()
=> 31,12 + 0,605.98 + 101(0,255 - b - x) = 24,88 + 39(0,255 - b - x) + 0,025.18 + 0,605.96 + 0,2.29,2 + 18(0,55 - x)
=> 62 + 44x = 6,98 (3)
Từ (1), (2) và (3)
=> a = 0,28 (mol) ; b = 0,04 (mol) ; x = 0,06 (mol
=> m = 24,88 + 39 ( 0,255 –b –x) + 0,025.18 + 0,605.96 = 88, 285 => nhận định a) sai
nKNO3 = 0,225 – b – x = 0,125 => nhận định b) sai
%FeCO3 = ( 0,04.116/ 31,12).100% = 14,91% => nhận định c) sai
nO = 4nFe3O4 + nFeCO3 => nFe3O4 = 0,06 => nhận định d) sai
=> có tất cả 4 nhận định sai.

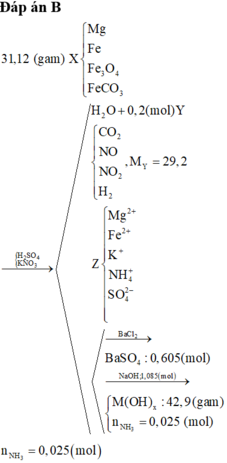
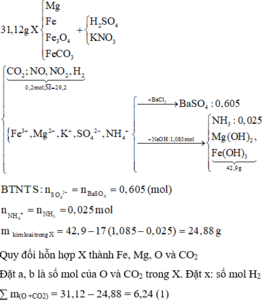
Y chứa H2 → Z không chứa NO3-. Lập sơ đồ phản ứng:
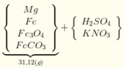
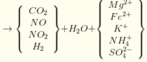
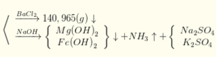
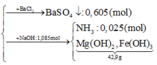
n(H2SO4) =n(SO42-) = n(BaSO4) = 0,605 mol; n(NH4+) = n(khí) = 0,025 mol
Áp dụng ĐLBT điện tích: n(Na+) + n(K+/Z) = 2n(SO42-)
→ n(KNO3) = n(K+) = 0,605*2 – 1,085 = 0,125 mol → (b) sai
Đặt n(Mg2+) = x; n(Fe2+) = y
→ (1) n(NaOH) = 2x + 2y + 0,025 = 1,085 mol
(2) m(kết tủa) = 58x + 90y = 42,9 gam
Giải (1) và (2): x = 0,15 mol; y = 0,38 mol → (e) đúng.
→ m = 0,15*24 + 0,38*56 + 0,125*39 + 0,025*18 + 0,605*96 = 88,285 gam → (a) sai
Áp dụng ĐLBT khối lượng: m(H2O) = 31,12 + 0,605*98 + 0,125*101 – 88,285 – 0,2*29,2 = 8,91
→ n(H2O) = 0,495 mol.
Áp dụng ĐLBT nguyên tố Hiđro: n(H2) = (0,605*2 – 0,025*4 – 0,495*2)/2 = 0,06 mol
Áp dụng ĐLBT nguyên tố Nitơ: Tổng n(NO, NO2) = tổng n(N/Y) = 0,125 – 0,025 = 0,1 mol
→ n(FeCO3) = n(CO2)= 0,2 – 0,1 – 0,06 = 0,04 mol; → %m(FeCO3) = 14,91% → (c) sai
m(X) = m(Mg) + m(Fe) + m(O) + m(CO32-) → m(O) = 31,12 – 0,15*24 -0,38*56 – 0,04*60 = 3,84
→ n(O) = 0,24 mol → n(Fe3O4) = 0,06 mol → (d) sai
Các kết luận không đúng là: (a); (b); (c); (d) → Đáp án D.

Chọn đáp án D
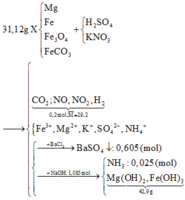
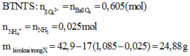
Quy đổi hỗn hợp X thành Fe, Mg, O và CO2
Đặt a, b là số mol của O và CO2 trong X. Đặt x là số mol H2
∑ m(O +CO2) = 31,12 – 24,88 = 6,24 (1)
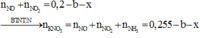
Sau phản ứng với dung dịch NaOH thu được dd chứa K2SO4 và Na2SO4
Bảo toàn điện tích:
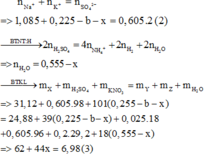
Từ (1), (2) và (3)
=> a = 0,28 (mol) ; b = 0,04 (mol) ; x = 0,06 (mol
=> m = 24,88 + 39 ( 0,255 –b –x) + 0,025.18 + 0,605.96 = 88, 285 => nhận định a) sai
nKNO3 = 0,225 – b – x = 0,125 => nhận định b) sai
%FeCO3 = ( 0,04.116/ 31,12).100% = 14,91% => nhận định c) sai
nO = 4nFe3O4 + nFeCO3 => nFe3O4 = 0,06 => nhận định d) sai
=> có tất cả 4 nhận định sai.

Đáp án D
Y chứa H2 → Z không chứa NO3-. Lập sơ đồ phản ứng:
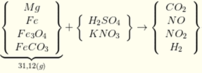
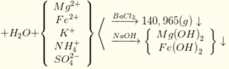
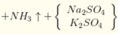
n(H2SO4) =n(SO42-) = n(BaSO4) = 0,605 mol; n(NH4+) = n(khí) = 0,025 mol
Áp dụng ĐLBT điện tích: n(Na+) + n(K+/Z) = 2n(SO42-)
→ n(KNO3) = n(K+) = 0,605*2 – 1,085 = 0,125 mol → (b) sai
Đặt n(Mg2+) = x; n(Fe2+) = y
→ (1) n(NaOH) = 2x + 2y + 0,025 = 1,085 mol
(2) m(kết tủa) = 58x + 90y = 42,9 gam
Giải (1) và (2): x = 0,15 mol; y = 0,38 mol → (e) đúng.
→ m = 0,15*24 + 0,38*56 + 0,125*39 + 0,025*18 + 0,605*96 = 88,285 gam → (a) sai
Áp dụng ĐLBT khối lượng: m(H2O) = 31,12 + 0,605*98 + 0,125*101 – 88,285 – 0,2*29,2 = 8,91
→ n(H2O) = 0,495 mol.
Áp dụng ĐLBT nguyên tố Hiđro: n(H2) = (0,605*2 – 0,025*4 – 0,495*2)/2 = 0,06 mol
Áp dụng ĐLBT nguyên tố Nitơ: Tổng n(NO, NO2) = tổng n(N/Y) = 0,125 – 0,025 = 0,1 mol
→ n(FeCO3) = n(CO2)= 0,2 – 0,1 – 0,06 = 0,04 mol; → %m(FeCO3) = 14,91% → (c) sai
m(X) = m(Mg) + m(Fe) + m(O) + m(CO32-) → m(O) = 31,12 – 0,15*24 -0,38*56 – 0,04*60 = 3,84
→ n(O) = 0,24 mol → n(Fe3O4) = 0,06 mol → (d) sai
Các kết luận không đúng là: (a); (b); (c); (d)

Đáp án B
nSO42- = nBaSO4 = 0,605 mol
nNH4+ = nNH3 = 0,025 mol
=> m kim loại trong X = 42,9 - 17(1,085 - 0,025) = 24,88
Đặt a, b là số mol O và CO2 trong X. Đặt X là số mol H2.
=> 16a + 44b = 31,12 - 24,88 = 6,24 (1)
nNO + nNO2 = 0,2 - b - x
Bảo toàn N: nKNO3 = nNO + nNO2 + nNH3
=>nKNO3 = 0,225 -b-x
Sau phản ứng với NaOH thu được phần dung dịch chứa K2SO4 và Na2SO4, bảo toàn điện tích:
1,085 + 0,225 - b - x = 0,605.2 (2)
Bảo toàn H: 2nH2SO4 = 4nNH4+ + 2nH2 + 2nH2O
=>nH2O = 0,555 -x
Bảo toàn khối lượng:
31,12 + 0,605 . 98 + 101 (0,225 - b - x) = 24,88 + 39(0,225 - b - x) + 0,025.18 + 0,605.96 + 0,2.29,2 + 18(0,555 - x) (3)
Giải hệ (1)(2)(3):
a = 0,28
b = 0,04
b = 0,04 X = 0,06
m = 24,88 + 39(0,225 - b - x) + 0,025.18 + 0,605.96 = 88,285 => Nhận định a) sai
nKNO3 = 0,225 - b - X = 0,125 => Nhận định b) sai
%FeCO3 = 0,04.116/31,12= 14,91 % => Nhận định c) sai
nO = 4nFe3O4 + nFeCO3 => nFe3O4 = 0,06 => Nhận định d) sai

Đáp án B
nSO42- = nBaSO4 = 0,605 mol
nNH4+ = nNH3 = 0,025 mol
=> m kim loại trong X = 42,9 - 17(1,085 - 0,025) = 24,88
Đặt a, b là số mol O và CO2 trong X. Đặt X là số mol H2.
=> 16a + 44b = 31,12 - 24,88 = 6,24 (1)
nNO + nNO2 = 0,2 - b - x
Bảo toàn N: nKNO3 = nNO + nNO2 + nNH3
=>nKNO3 = 0,225 -b-x
Sau phản ứng với NaOH thu được phần dung dịch chứa K2SO4 và Na2SO4, bảo toàn điện tích:
1,085 + 0,225 - b - x = 0,605.2 (2)
Bảo toàn H: 2nH2SO4 = 4nNH4+ + 2nH2 + 2nH2O
=>nH2O = 0,555 -x
Bảo toàn khối lượng:
31,12 + 0,605 . 98 + 101 (0,225 - b - x) = 24,88 + 39(0,225 - b - x) + 0,025.18 + 0,605.96 + 0,2.29,2 + 18(0,555 - x) (3)
Giải hệ (1)(2)(3):
a = 0,28
b = 0,04
b = 0,04 X = 0,06
m = 24,88 + 39(0,225 - b - x) + 0,025.18 + 0,605.96 = 88,285 => Nhận định a) sai
nKNO3 = 0,225 - b - X = 0,125 => Nhận định b) sai
%FeCO3 = 0,04.116/31,12= 14,91 % => Nhận định c) sai
nO = 4nFe3O4 + nFeCO3 => nFe3O4 = 0,06 => Nhận định d) sai

Đáp án B
nSO42- = nBaSO4 = 0,605 mol
nNH4+ = nNH3 = 0,025 mol
=> m kim loại trong X = 42,9 - 17(1,085 - 0,025) = 24,88
Đặt a, b là số mol O và CO2 trong X. Đặt X là số mol H2.
=> 16a + 44b = 31,12 - 24,88 = 6,24 (1)
nNO + nNO2 = 0,2 - b - x
Bảo toàn N: nKNO3 = nNO + nNO2 + nNH3
=>nKNO3 = 0,225 – b - x
Sau phản ứng với NaOH thu được phần dung dịch chứa K2SO4 và Na2SO4, bảo toàn điện tích:
1,085 + 0,225 - b - x = 0,605.2 (2)
Bảo toàn H: 2nH2SO4 = 4nNH4+ + 2nH2 + 2nH2O
=>nH2O = 0,555 -x
Bảo toàn khối lượng:
31,12 + 0,605 . 98 + 101 (0,225 - b - x) = 24,88 + 39(0,225 - b - x) + 0,025.18 + 0,605.96 + 0,2.29,2 + 18(0,555 - x) (3)
Giải hệ (1)(2)(3):
a = 0,28
b = 0,04
b = 0,04 X = 0,06
m = 24,88 + 39(0,225 - b - x) + 0,025.18 + 0,605.96 = 88,285 => Nhận định a) sai
nKNO3 = 0,225 - b - X = 0,125 => Nhận định b) sai
%FeCO3 = 0,04.116/31,12= 14,91 % => Nhận định c) sai
nO = 4nFe3O4 + nFeCO3 => nFe3O4 = 0,06 => Nhận định d) sai