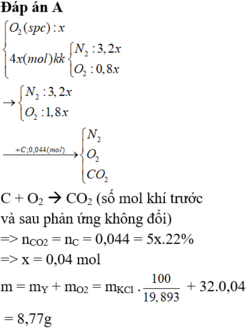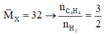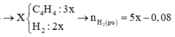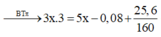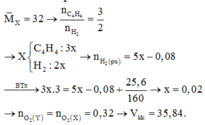Trộn 300ml chất CxHy (ở thể khí ở nhiệt độ thường) và N2 với 1000ml O2 thu được hỗn hợp Y.Đốt cháy hỗn hợp Y thu được 1400ml hỗn hợp Z.Làm lạnh hỗn hợp khí Z thu được 800ml hỗn hợp khí R.Cho khí R đi qua bình đựng dung dịch nước vôi trong dư thu được 400ml hỗn hợp khí T.Các thể tích đo ở cùng điều kiện nhiêt độ và áp suất.xác định công thức CxHy
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : A
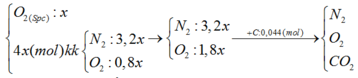
C + O2 à CO2 ( số mol khí trước và sau phản ứng không đổi)
=> nCO2 = nC = 0,044 = 5x.22% => x = 0,04 mol
m = mY + mO2 = mKCl. 100 19 , 893 + 32.0,04 = 8,77g

Vì bài toán chỉ có số liệu tương đối (%) nên để đơn giản và không mất tính tổng quát, ta có thể chọn số mol một chất bất kì. Ta chọn nX = 1(mol)
![]()
Khi làm lạnh thì hơi nước ngưng tụ vậy Y chỉ chứa CO2 và O2 dư.
Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
a → a(x + 0,25y) ax 0,5ay
dư: 1 – a – a(x + 0,25y)

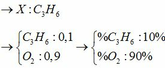

Giả sử hỗn hợp có x mol O2 và y mol N2
Ta có: \(\overline{M}=\dfrac{32x+28y}{x+y}>29\)
=> 32x + 28y > 29x + 29y
=> 3x > y
=> \(\dfrac{x}{y}>\dfrac{1}{3}\)
Vậy cần trộn O2 và N2 sao cho tỉ lệ \(\dfrac{V_{O_2}}{V_{N_2}}>\dfrac{1}{3}\) để thu được hỗn hợp Y nặng hơn không khí