cho 11,3g hỗn hợp gồm metan,etilen,axetilen tác dụng vs brom dư thì k/lượng brom phản ứng là 72g.Mặt khác nếu cho toàn bộ hỗn hợp khí trên tác dụng vs 1 lượng dư bạcnitrat amoniac thu được 36g kết tủa
a) viết các pt xảy ra
b) tính % thể tích của các chất trong hỗn hợp ban đầu
Giup1 em vs...tks nkju ak

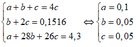

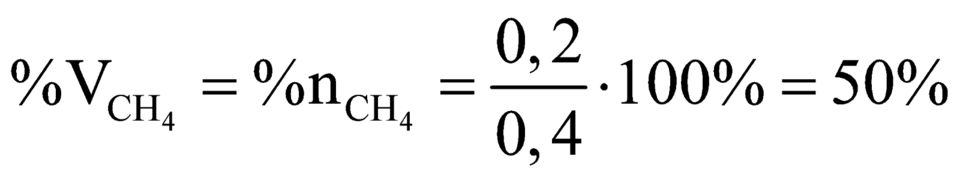
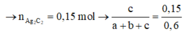

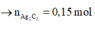
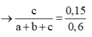
a) TN1: C2H4 + Br2---->C2H4Br2 (1) ,C2H2 + 2Br2----> C2H2Br4 (2), TN2: C2H2+ 2AgNO3+2NH3--->Ag2C2 +2NH4NO3 (3)
b) Đặt số mol: nC2H4=a(mol), nC2H2=b(mol), nCH4=c(mol). Theo TN2 và pt(3) => b=nAg2C2=36/MAg2C2=0,15(mol)=>mC2H2=3,9(gam).Theo TN1 và pt(1) và pt(2): a.160+ 2b.160=72 , b=0,15 =>a=0,15=> mC2H4=3.2(gam)=> mCH4=11,3-3,9-3,2=4,2(gam) =>nCH4=0,2(mol).Tổng thể tích của hỗn hợp=(a+b+c).22,4=11.2(lit)
phần trăm về thể tích của metan trong hỗn hợp đầu=[(0,2.22,4)/11,2].100%=40%
phần trăm về thể tích của etilen trong hỗn hợp đầu=[(0,15.22,4)/11,2].100%=30%
phần trăm về thể tích của axetilen trong hỗn hợp đầu=100%-30%-40%=30%
a) ptr pứ:
CH4+Br2→CH3Br+HBr
C2H4+Br2→C2H4Br2
C2H2+2Br2→C2H2Br4
C2H2+2AgNO3+2NH3→2NH4NO3+C2Ag2
b) Câu này chắc là phản ứng cộng với Br2 mới ra
nBr2=0,45mol ; nC2Ag2=0,15mol
C2H4 + Br2 ---> C2H4Br2
y ------> y
C2H2 + 2Br2 -----> C2H2Br4
z --------> 2z
==> y +2z = 0,45 (1)
C2H2 + 2AgNO3 + 2NH3 → 2NH4NO3 + C2Ag2
z=0,15 (2) <------------------------------------------ 0,15
btkl: 16x + 28y + 26z=11,3 (3)
giải hệ (1) (2) (3)
x=0,2; y=0,15; z=0,15
=> %VCH4=40%;
%VC2H4=30%
%VC2H2=30%