Cho m gam Fe vào 400ml dd HNO3 2M, thấy thoát ra khí NO (spk duy nhất). dd sau phản ứng chứa 3m gam muối. Tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
![]()
Sau phản ứng còn lại 0,2m gam chất rắn.
=> kim loại dư ![]()
![]()
Bảo toàn khối lượng: m + 0,4.63 + 0,2.98 = 0,2m + 50 + 0,4.18 + 0,2.30 => m = 23(g)
=> Chọn A

Giải thích: Đáp án A
n Fe = 0.2 mol , n Cu(NO3)2 = 0,2 mol => n NO3- = 0,4 mol
n HCl = n H+ = 0,4 mol
Fe + 4 H+ + NO3-→ Fe3+ + NO + 2 H2O
0,2 0,4 0,4 =>0,1 0,1 mol
=> V NO = 2,24 l
=> n Fe dư = 0,2- 0,1 = 0,1 mol
Fe +2 Fe3+→3 Fe2+
0,1 0,1 0,15 mol
=> n Fe dư = 0,05 mol
Fe + Cu2+ →Fe2++ Cu
0,05 0,2 => 0,05
=> m Cu = 0,05 . 64 = 3,2 g

Đáp án D
Ta có nFe = 0,12 mol ⇒ ∑ne cho max = 0,36 mol và ∑ne cho min = 0,24 mol.
Vì NO là sản phẩm khử duy nhất của N+5 ⇒ nNO max = nHNO3 ÷ 4 = 0,1 mol.
⇒ ne nhận tối đa = 3×nNO = 0,3 mol.
Nhận thấy 0,24 < 0,3 < 0,36 ⇒ Fe tan hết tạo 2 muối.
⇒ mMuối = mFe + mNO3– = 6,72 + 3nNO×62 = 25,32 gam
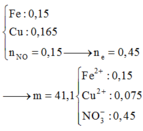

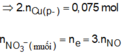
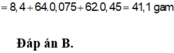
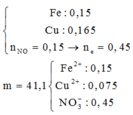
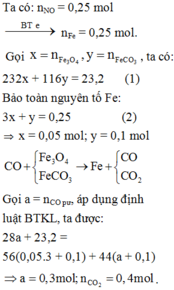
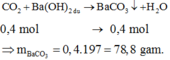

Fe + 4HNO3 →Fe(NO3)3 + NO + 2H2O
\(n_{HNO_3}=0,4.2=0,8\left(mol\right)\)
TH1 : 2 chất đều phản ứng hết
\(n_{Fe}=\dfrac{0,8}{4}=0,2\left(mol\right)\)
=> m Fe=11,2g
\(n_{Fe\left(NO_3\right)_3}=\dfrac{0,8}{4}=0,2\left(mol\right)\)
=> \(m_{Fe\left(NO_3\right)_3}=0,2.242=48,4\left(g\right)\)
Theo đề m gam Fe ------> 3m gam muối
Mà \(\dfrac{48,4}{11,2}=4,32\)
Vậy TH này loại
TH2: HNO3 dư
Fe + 4HNO3 →Fe(NO3)3 + NO + 2H2O
\(\dfrac{m}{56}\)--->\(\dfrac{m}{14}\)---->\(\dfrac{m}{56}\)
=> \(\dfrac{m}{56}=\dfrac{3m}{56+62.3}\)
=> m=0 (loại)
TH3: Fe dư
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
0,2<--0,8---------->0,2
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
\(\dfrac{m}{56}-0,2\)---------------------------------------->\(3\left(\dfrac{m}{56}-0,2\right)\)
=> \(n_{Fe\left(NO_3\right)_3}=3\left(\dfrac{m}{56}-0,2\right)=\dfrac{3m}{56+62.3}\)
=>m=\(\dfrac{6776}{465}\left(g\right)\approx14,572\left(g\right)\)