hòa tan 5,6g Fe vào 300g đ HCl 3,65%. tính C% của dd sau pứ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{300\cdot3.65\%}{36.5}=0.3\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Lập tỉ lệ :
\(\dfrac{0.1}{1}< \dfrac{0.3}{2}\) => HCl dư
\(n_{FeCl_2}=n_{H_2}=0.1\left(mol\right)\)
\(n_{HCl\left(dư\right)}=0.3-0.1\cdot2=0.1\left(mol\right)\)
\(m_{dd}=5.6+300-0.1\cdot2=305.4\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{0.1\cdot127}{305.4}\cdot100\%=4.15\%\)
\(C\%_{HCl\left(dư\right)}=\dfrac{0.1\cdot36.5}{305.4}\cdot100\%=1.2\%\)

\(n_{HCl}=200.3,65\%=7,3g\)
\(m_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 0,2 0,1 ( mol )
\(m_{Mg}=0,1.24=2,4g\)
\(V_{H_2}=0,1.22,4=2,24l\)
Mg + 2HCl -- > MgCl2 + H2
mHCl = (200.3,65) / 100 = 7,3(g)
=> nHCl = 7,3 : 36,5 = 0,2 (mol)
=> nH2 = 0,1 (mol)
=> VH2 = 0,1 .22,4 = 2,24(l)
nMg = nHCl = 0,2(mol)
mMg = 0,1 . 24 = 2,4(g)

bài 2 nCO2=\(\frac{4,48}{22,4}\)= ( chắc đề bạn ghi thiếu )
pt: CaCO3 + 2HCl --> CaCl2 + H2O + CO2
0,2mol 0,2mol 0,2mol 0,2mol
a, ta có : nCaCO3=nCO2=0,2 mol
=> mCaCO3=0,2.100=20(g)
b,nHCl=2nCO2=0,4 mol
=>mHCl=0.4.36,5=14,6(g)
=> mddHCl=\(\frac{14,6.100}{3,65}\)=400(g)
c,nCaCl2=nCO2=0,2mol
=> mCaCl2=0,2.111=22.2(g)
=> mCO2(thoát ra ) =0,2.44=8.8(g)
=>mddSPU=400+40-8,8=431.2g
=>C%CaCl2= \(\frac{22,2}{431,2}.100\)
=5,14%
d,pt :Ba(OH)2 +CO2 --> BaCO3(chat k tan trong H2O)+ H2O
0,2mol 0,2mol
mBa(OH)2=0,2.171=34,2g
het.....:v
1,
a, \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
b, \(n_{CO_2}=\frac{V}{22.4}=\frac{3.36}{22.4}=0.15\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=V\times C_M=0.4\times1=0.4\left(mol\right)\)
Ta có tỉ lệ \(n_{CO_2}< n_{Ca\left(OH\right)_2}\) nên ta tính theo số mol của CO2
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
0.15 0.15 0.15 0.15 (mol)
Khối lượng Ca(OH)2 dư là \(m_{Ca\left(OH\right)_2du}=n_{du}\times M=\left(0.4-0.15\right)\times74=18.5\left(g\right)\)
c, \(C_{MCaCO_3}=\frac{n}{V}=\frac{0.15}{0.4}=\frac{3}{8}\left(M\right)\)
\(C_{MCa\left(OH\right)_2du}=\frac{n}{V}=\frac{0.4-0.15}{0.4}=\frac{5}{8}\left(M\right)\)
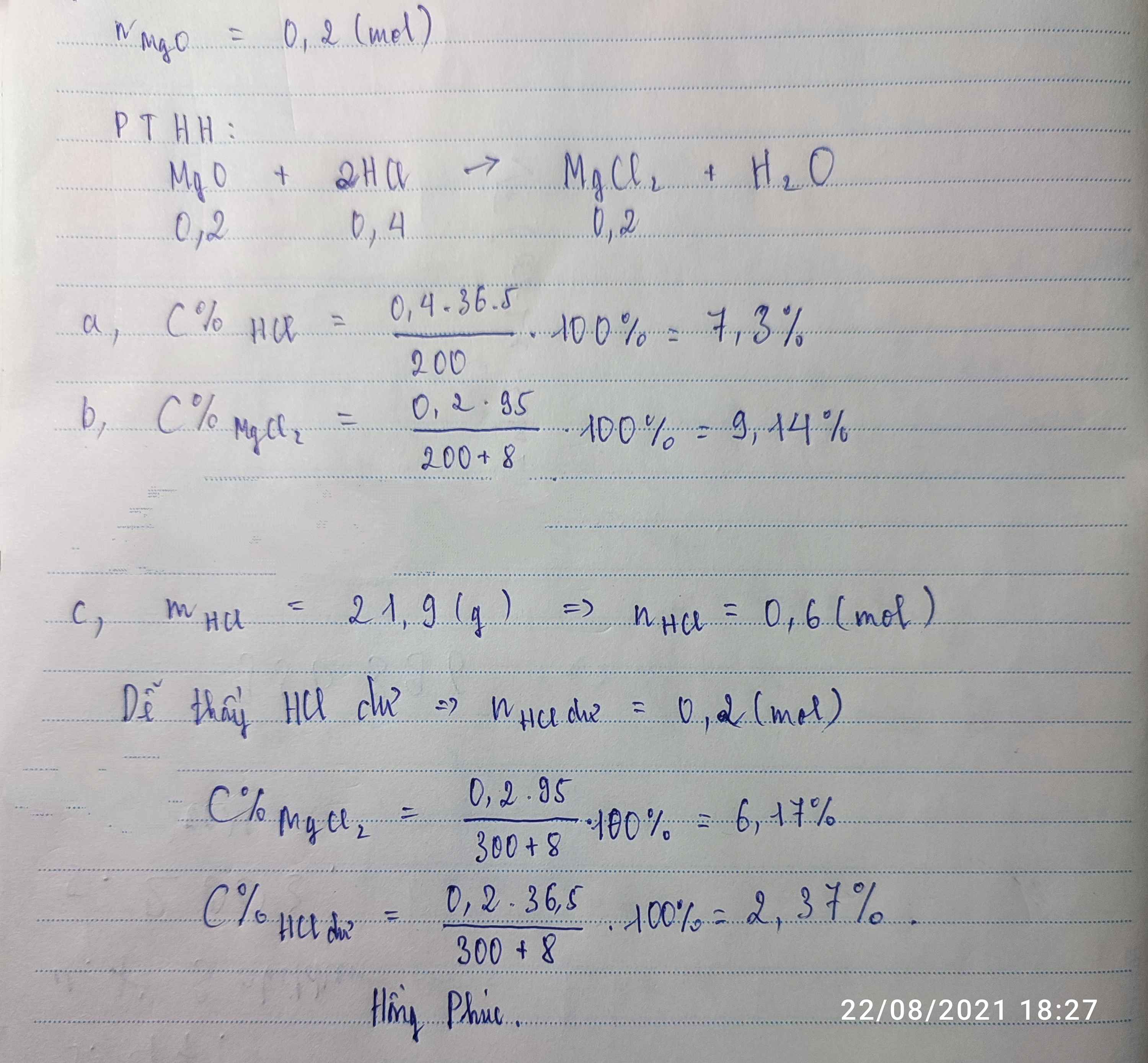
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Khối lượng của axit clohidric C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{3,65.300}{100}=10,95\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,1 0,3 0,1 0,1
Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ Fe phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol Fe
Số mol của sắt clorua
nFeCl2 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của sắt clorua
mFeCl2 = nFeCl2 . MFeCl2
= 0,1 . 127
=12,7 (g)
Số mol dư của axit clohidric
ndư = nban đầu - nmol
= 0,3 - (0,1 . 2)
= 0,1 (mol)
Khối lượng dư của axit clohidric
mdư = ndư . MHCl
= 0,1 . 36,5
= 3,65 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mH2SO4 - mH2
= 5,6 + 300 - (0,1 . 2)
= 305,4 (g)
Nồng độ phần trăm của sắt clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{12,7.100}{305,4}=4,16\)0/0
Nồng độ phần trăm của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{3,65.100}{305,4}=1,19\)0/0
Chúc bạn học tốt
Em tính C% như thế không đúng rồi. Dung dịch sau phản ứng có HCl dư nữa mà, ghi rõ từng chất sẽ tốt hơn em ạ :3