Cho a gam hỗn hợp Cu và Mg vào 200 gam dung dịch H2SO4 loãng dư. Sau phản ứng thấy có 6,4 gam một chất rắn không tan và có 6,72 lít khí thoát ra ở điều kiện tiêu chuẩn. Tính a gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{0,336}{22,4}=0,015mol\)
\(\Rightarrow n_{HCl}=2n_{H_2}=2\cdot0,015=0,03mol\)
\(\Rightarrow n_{Cl^-}=0,03mol\Rightarrow m_{Cl^-}=1,065g\)
\(m_{CRắn}=m_{kl}+m_{Cl^-}=1,065+1,5=2,565g\)

a)
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
b) Chất rắn không tan là Cu $\Rightarrow m_{Cu} = 1,28(gam)$
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 24a + 56b + 1,28 = 2,44(1)$
Theo PTHH :
$n_{H_2} = a + b = \dfrac{0,784}{22,4} = 0,035(2)$
Từ (1)(2) suy ra : a = 0,025 ; b = 0,01
$\%m_{Mg} = \dfrac{0,025.24}{2,44}.100\% = 24,6\%$
$\%m_{Fe} = \dfrac{0,01.56}{2,44}.100\% = 23\%$
$\%m_{Cu} = 100\% - 24,6\% - 23\% = 52,4\%$

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)
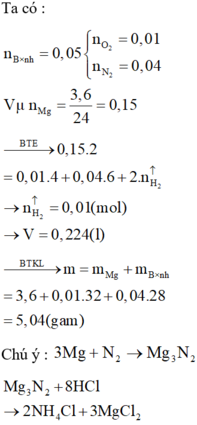
m(rắn)=mCu=6,4(g)
nH2=6,72/22,4=0,3(mol)
PTHH: Mg + H2SO4 -> MgSO4+ H2
nMg=nH2=0,3(mol)
=>a=m(hhCu,Mg)=mCu+mMg=6,4+0,3.24= 13,6(g)
=>a=13,6(g)
Chúc em học tốt!
PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)=n_{Mg}\)
\(\Rightarrow a=0,3\cdot24+6,4=13,6\left(g\right)\)