Tính pH của các dung dịch sau :
a) dung dịch HNO3 0,1M
b) dung dịch Ca(OH)2 0,05M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(\left[H^+\right]=0,01.2=0,02M\)
=> pH = 1,7
b) \(\left[OH^-\right]=0,03.2=0,06M\)
=> pOH= 1,22
=> \(pH=14-1,22=12,78\)
a) pH= -log[H+]= -log[0,01.2]=1,69
b) pH= 14 - pOH= 14 + log[OH-]= 14+ log[0,03.2]=12,78

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1
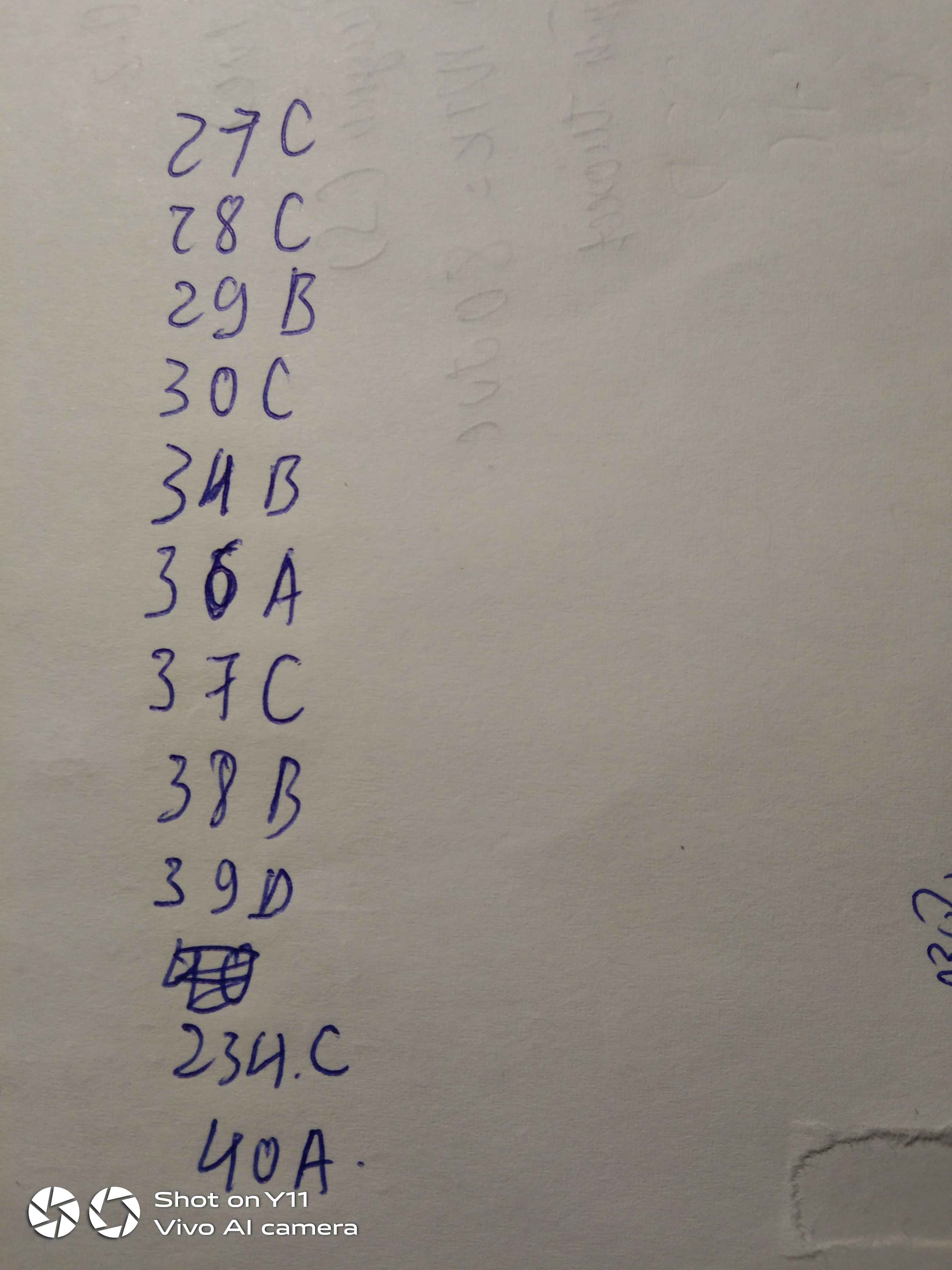

a) pH= -log[H+]= -log[0,1]=1
b) pH= 14- p[OH-]= 14+log[0,1]=13
Bạn ơi bạn có thể cho mình hỏi là pH=14-p(OH-) mà số 14 đó ở đâu ra được hem