Cho 13,44 (l) CO2 (đktc) phản ứng hết với V (l) dung dịch Ca(OH)2 4M. Sau phản ứng cô cạn thu được 74,8 (g) chất rắn. Tính V=?(l)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Ba\left(OH\right)_2}=C_M\cdot V=0,05\cdot2=0,1\left(mol\right)\)
\(n_{NaOH}=C_M\cdot V=0,1\cdot2=0,2\left(mol\right)\)
PTHH
CO2 + Ba(OH)2 ----> BaCO3 + H2O
..0,1.......0,1....................0,1.......0,1
=> nCO2 còn lại = 0,3 - 0,1 = 0,2
CO2 +2NaOH ----> Na2CO3 + H2O
..0,1....0,2...................0,1.........0,1...(mol)
=> nCO2 còn lại = 0,2- 0,1 0,1 (mol)
CO2 + Na2CO3 + H2O ---->2NaHCO3
0,1..........0,1.........0,1..............0,2....(mol)
=> kết tủa là BaCO3
=> dd X là NaHCO3 ( do Na2CO3 tạo ra lại phản ứng hết với CO2 )
=> m = 0,1 . 171 = 17,1(g)
mk nhớ ko nhầm đây là hóa 8 mà -.-
=> m1 = 0,2 . 84 = 16,8(g)

Chọn B
Ta có: 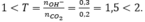
Sau phản ứng thu được các muối CaCO 3 : x mol và Ca(HCO3)2 y mol.
Bảo toàn C có: x + 2y = 0,2 (1)
Bảo toàn Ca có: x + y = 0,15 (2)
Từ (1) và (2) có x = 0,1 và y = 0,05.
Cô cạn hỗn hợp phản ứng:
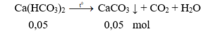
Chất rắn sau phản ứng là CaCO 3 (0,1 + 0,05 = 0,15 mol)
m cr = 0,15.100 = 15 gam.

nCa(OH)2= 0,2 mol
nCaCO3= 0,1 mol
\(\rightarrow\)Một phần kt bị hoà tan
Ca(OH)2+ CO2 \(\rightarrow\) CaCO3+ H2O
\(\rightarrow\) nCO2 tạo kt= 0,2 mol
Ban đầu tạo ra 0,2 mol CaCO3, nhưng chỉ thu đc 0,1 mol CaCO3 nên 0,1 mol CaCO3 bị hoà tan
CaCO3+ CO2+ H2O \(\rightarrow\)Ca(HCO3)2
\(\rightarrow\) nCO2 hoà tan kt= 0,1 mol
Tổng mol CO2 bđ= 0,1+0,2= 0,3 mol
V CO2= 0,3.22,4= 6,72l

nCO2=13,44/22,4=0,6(mol)
mCO2=0,6.44=26,4(g)
PTHH:CO2+Ca(OH)2-->CaCO3
dùng ĐLBTKL ta có:
mCO2+mCa(OH)2=mCaCO3
mCa(OH)2=74,8-26,4=48,4(g)
-->nCa(OH)2=48,4/74=0,65(mol)
-->VCa(OH)2=0,65/2,4=0,27(lít)
nếu sai rất mong mọi người giúp đỡ
Sai rồi nha cậu . Cảm ơn cậu đã giúp
. Cảm ơn cậu đã giúp