Cho 400g dung dịch NaOH 30% tác dụng với 200ml dung dịch Hcl 20%( D=1,14g/ml).Tính C% các chất trong dung dịch sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CaCO_3}=\dfrac{40}{100}=0,4\left(mol\right)\\ CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\\ CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\\ n_{CO_2}=n_{CaCO_3}=0,4\left(mol\right)\\ \Rightarrow n_{NaOH}=0,4.2=0,8\left(mol\right)\\ m_{NaOH}=0,8.40=32\left(g\right)\\ \Rightarrow m_{ddNaOH}=\dfrac{32.100}{25}=128\left(g\right)\\ \Rightarrow V_{ddNaOH}=\dfrac{m_{ddNaOH}}{D_{ddNaOH}}=\dfrac{128}{1,28}=100\left(ml\right)=0,1\left(l\right)\)

a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\), ta được HCl dư.
Theo PT: \(\left\{{}\begin{matrix}n_{FeCl_2}=n_{H_2}=n_{Fe}=0,2\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{Fe}=0,4\left(mol\right)\Rightarrow n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\)
b, Dung dịch a gồm HCl dư và FeCl2.
PT: \(HCl+NaOH\rightarrow NaCl+H_2O\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_{2\downarrow}+2NaCl\)
Theo PT: \(n_{NaOH}=n_{HCl\left(dư\right)}+2n_{FeCl_2}=0,5\left(mol\right)\)
\(\Rightarrow a=C_{M_{NaOH}}=\dfrac{0,5}{0,2}=2,5M\)
c, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Bạn tham khảo nhé!

a/ \(n_{KOH}=0,2.1=0,2\left(mol\right);n_{H_2SO_4}=0,3.1=0,3\left(mol\right)\)
PTHH: 2KOH + H2SO4 → K2SO4 + 2H2O
Mol: 0,2 0,1 0,1
Ta có: \(\dfrac{0,2}{2}< \dfrac{0,3}{1}\) ⇒ KOH hết, H2SO4 dư
b/ \(m_{H_2SO_4dư}=\left(0,3-0,1\right).98=19,6\left(g\right)\)
c/ Vdd sau pứ = 0,2 + 0,3 = 0,5 (l)
d/ \(C_{M_{ddK_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)
\(C_{M_{ddH_2SO_4dư}}=\dfrac{0,3-0,1}{0,5}=0,4M\)

Gọi n H C l = x m o l
Coi hh X gồm C H 3 − C H ( N H 2 ) C O O H và HCl không phản ứng với nhau và đều phản ứng với NaOH
→ m H C l = m X – m C H 3 − C H ( N H 2 ) C O O H = 28 , 75 – 0 , 2.89 = 10 , 95 g a m
→ n H C l = 0 , 3 m o l
→ n N a O H p h ả n ứ n g = n g ố c C O O H + n H C l = 0 , 2 + 0 , 3 = 0 , 5 m o l
→ V = 500 ml
Đáp án cần chọn là: C

Gọi n H C l = x m o l
Coi hh X gồm C H 3 − C H ( N H 2 ) C O O H và HCl không phản ứng với nhau và đều phản ứng với NaOH
→ m H C l = m X – m a m i n o a x i t = 1 , 62 – 0 , 01.89 = 0 , 73 g a m
→ n H C l = 0 , 02 m o l
→ n N a O H p h ả n ứ n g = n g ố c C O O H + n H C l = 0 , 01 + 0 , 02 = 0 , 03 m o l
→ V = 30 ml
Đáp án cần chọn là: D

\(n_{CuSO_4}=\dfrac{15,2}{160}=0,095mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,095 0,19 0,095 0,095
\(m_{rắn}=m_{Cu\left(OH\right)_2}=0,095.98=9,31g\\ V_{ddNaOH}=\dfrac{0,19}{2}=0,095l\\ b)C_{M_{Na_2SO_4}}=\dfrac{0,095}{0,04+0,095}\approx0,7M\\ c)Cu\left(OH\right)_2\xrightarrow[t^0]{}CuO+H_2O\)
0,095 0,095
\(m_{rắn}=m_{CuO}=0,095.80=7,6g\)
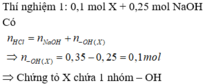

\(n_{NaOH}=\dfrac{400.30\%}{40}=3\left(mol\right)\)
\(n_{HCl}=\dfrac{1,14.200.20\%}{36,5}=1,25\left(mol\right)\)
PTHH: NaOH + HCl ----------> NaCl +H2O
Theo đề : 3.........1,25
Lập tỉ lệ :\(\dfrac{3}{1}>\dfrac{1,25}{1}\)=> Sau phản ứng NaOH dư, HCl phản ứng hết
Vậy các dung dịch sau phản ứng là NaOH dư và NaCl
Ta có : \(n_{NaCl}=n_{HCl}=1,25\left(mol\right)\)
\(n_{NaOHdư}=3-1,25=1,75\left(mol\right)\)
\(m_{ddsaupu}=400+1,14.200=628\left(g\right)\)
\(C\%_{NaOHdư}=\dfrac{1,75.40}{628}.100=11,15\%\)
\(C\%_{NaCl}=\dfrac{1,25.58,5}{628}.100=11,64\%\)
Ta có: \(m_{NaOH}=400.30\%=120\left(g\right)\Rightarrow n_{NaOH}=\dfrac{120}{40}=3\left(mol\right)\)
m dd HCl = 200.1,14 = 228 (g)
\(\Rightarrow m_{HCl}=228.20\%=45,6\left(g\right)\Rightarrow n_{HCl}=\dfrac{45,6}{36,5}=\dfrac{456}{365}\left(mol\right)\)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Xét tỉ lệ: \(\dfrac{3}{1}>\dfrac{\dfrac{456}{365}}{1}\), ta được NaOH dư.
Theo PT: \(n_{NaOH\left(pư\right)}=n_{NaCl}=n_{HCl}=\dfrac{456}{365}\left(mol\right)\)
\(\Rightarrow n_{NaOH\left(dư\right)}=\dfrac{639}{365}\left(mol\right)\)
Ta có: m dd sau pư = 400 + 228 = 628 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{NaCl}=\dfrac{\dfrac{456}{365}.58,5}{628}.100\%\approx11,64\%\\C\%_{NaOH\left(dư\right)}=\dfrac{\dfrac{639}{365}.40}{628}.100\%\approx11,15\%\end{matrix}\right.\)
Bạn tham khảo nhé!