Trộn 2 dung dịch NaOH 3% và 10% theo tỉ lệ khối lượng là bao nhiêu để được là bao nhiêu để được dung dịch NaOH 8%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Trả lời :
- Cần trộn dd NaOH 3% và 10% với tỉ lệ khối lượng 2 : 5 để có dd NaOH 8%
~HT~
#NDH

* Phần tính toán:
Khối lượng dung dịch NaOH: m d d = D.V = 1,1.2000=2200(g)
Khối lượng NaOH có trong 2 lit dung dịch:
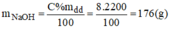
Gọi x(ml) là thể tích của dung dịch NaOH 3% ⇒ m d d = V.d = 1,05.x
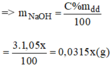
Gọi y(ml) là thể tích của dung dịch NaOH 10% ⇒ m d d = V.d = 1,12.y
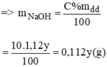
Ta có hệ phương trình sau: 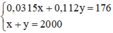
Giải hệ phương trình trên, ta được: 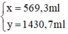
* Cách pha chế:
Đong lấy 569,3ml dung dịch NaOH 3% và 1430,7ml dung dịch NaOH 10% vào bình có dung dịch khoảng 3 lit. Trộn đều ta được 2 lit dung dịch NaOH 8% có khối lượng riêng 1,1g/ml.

\(a) V_A = 2(lít) \to V_B = 3(lít)\\ \Rightarrow V_{dd} = 2 + 3 = 5(lít)\\ n_{H_2SO_4\ trong\ C} = 0,2.2 + 0,5.3 = 1,9(mol)\\ C_{M_{H_2SO_4}} = \dfrac{1,9}{5} = 0,38M\)

Câu 2:
Gọi khối lượng của ddNaCl 2% và 10% lần lượt là m1 và m2
\(m_{NaCl\left(1\right)}=\dfrac{2}{100}m_1;m_{NaCl\left(2\right)}=\dfrac{10}{100}m_2\)
\(\Rightarrow m_{NaCl\left(3\right)}=\dfrac{2}{100}m_1+\dfrac{10}{100}m_2=0,02m_1+0,1m_2\) (1)
\(m_{ddNaCl\left(3\right)}=m_1+m_2\)
Ta có: \(m_{NaCl\left(3\right)}=\dfrac{8.\left(m_1+m_2\right)}{100}=0,08\left(m_1+m_2\right)\) (2)
Từ (1)(2)
\(\Rightarrow0,02m_1+0,1m_2=0,08m_1+0,08m_2\)
\(\Leftrightarrow0,02m_2=0,06m_1\Rightarrow\dfrac{m_1}{m_2}=\dfrac{0,02}{0,06}=\dfrac{1}{3}\)
Câu 1:
\(n_{KOH}=2,4.160=384\left(mol\right)\)
\(V_{ddKOH2M}=\dfrac{384}{2}=192\left(l\right)\)
⇒ Vnước thêm vào = 192-160 = 32 (l)

Câu 5:
\(Đặt:V_{H_2O}=a\left(l\right)\left(a>0\right)\\ n_{KOH}=160.2,4=384\left(mol\right)\\ Vì:C_{MddKOH\left(cuối\right)}=2\left(M\right)\\ \Leftrightarrow\dfrac{384}{160+a}=2\\ \Leftrightarrow a=32\left(lít\right)\)
Vậy cần thêm 32 lít H2O

Đáp án A
Gọi thể tích dung dịch A là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch B là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9

Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
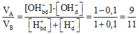

Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11

Đáp án:
2 : 5
Giải thích các bước giải:
Gọi khối lượng dung dịch NaOH 3%, dung dịch NaOH 10% là m1, m2
Trong m1 g dd NaOH 3% có: mNaOH = m1 . 3% = 0,03.m1 (g)
Trong m2 g dd NaOH 10% có mNaOH = m2 . 10% = 0,1 . m2 (g)
Khi trộn 2 dung dịch trên với nhau thu được dung dịch có
mdd = m1 + m2 (g)
mNaOH = 0,03.m1 + 0,1.m2 (g)
Dung dịch thu được có C% = 8%
0,03.m1+0,1.m2:m1+m2.100%=8%
→0,02.m2=0,05.m1
→m1:m2=2/5
học tốt
Giải thích rõ cho mik đc hok ah