23. Một phản ứng có tốc độ phản ứng ở ở 50o C là 10−5 mol/l.s; ở 100o C, tốc độ phản ứng bằng 10−2 mol/l.s. Tính năng lượng hoạt hóa dựa vào phương trình Arrhenius. Cho biết R = 1,987 cal/mol.K.
24. Tính tốc độ trung bình của phản ứng, biết rằng khi bắt đầu phản ứng, nồng độ của một chất là 0,1 mol/l; sau 1 phút nồng độ của chất còn lại 0,05 mol/l.
25. Một phản ứng có hệ số nhiệt độ của tốc độ phản ứng bằng 3,33. Ở 25°C, phản ứng kết thúc sau 2 giờ. Dựa vào quy tắc thực nghiệm Van’t Hoff, cho biết sau bao lâu phản ứng kết thúc nếu tiến hành phản ứng ở 80°C.
giúp các ậu ạ


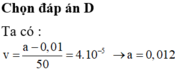
Câu 23 bạn tự áp vào công thức là tính ra Ea thôi. Nên em tự làm nhé
Câu 24: \(\overline{v}=\frac{\left|\Delta C\right|}{\Delta t}=\frac{0,05}{1}=0,05M.phút^{-1}\)
Câu 25
vsau = vtrước.3,33(80-25):10= 747.vtrước
=> Thời gian thực hiện pứ = 2/747 giờ