Hợp chất B có %Fe=28%; %S=24%, còn lại là O Biết hối lượng mol B là 400. Viết CTHH dưới dạng Fex(SO4)y. Xác định CTHH
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


câu a ko hiểu cho lắm
b) vì nhóm SO4(2) kim loại (3)
suy ra muối có ct là R2(SO4)3 R chieems28% về khối lg==>\(\frac{2R}{2R+3SO4}\)=0.28
suy ra 2R=0.28(2R+288) tìm đc R=56==. Fe

Đặng Khánh Duy ơ mình đoán mò, nhưng tìm % theo khôi lượng là đúng

a) CTHH: \(H_xS\)
Ta có : \(\dfrac{32}{x+32}=94,12\%\Rightarrow x=2\)
=> CTHH: \(H_2S\)
Ý nghĩa : hợp chất được tạo từ 2 nguyên tố H, S
Trong 1 phân tử chất có 1 nguyên tử H và 2 nguyên tử S
Phân tử khối của hợp chất là 2 + 32 = 34 đvC
b) Gọi CTHH của hợp chất là \(Na_xAl_yO_z\)
Ta có : \(x:y:z=\dfrac{28}{23}:\dfrac{33}{27}:\dfrac{39}{16}=1:1:2\)
Vậy CTHH của hợp chất là \(NaAlO_2\)

b) CT hợp chất của R với hidro là RH3
Có \(\dfrac{3}{M_R+3}.100\%=8,82\%=>M_R=31\left(P\right)\)
CT oxit cao nhất: P2O5
CT hidroxit: H3PO4
c) CT oxit cao nhất: RO2
\(\dfrac{32}{M_R+32}.100\%=53,3\%\) => MR = 28 (Si)
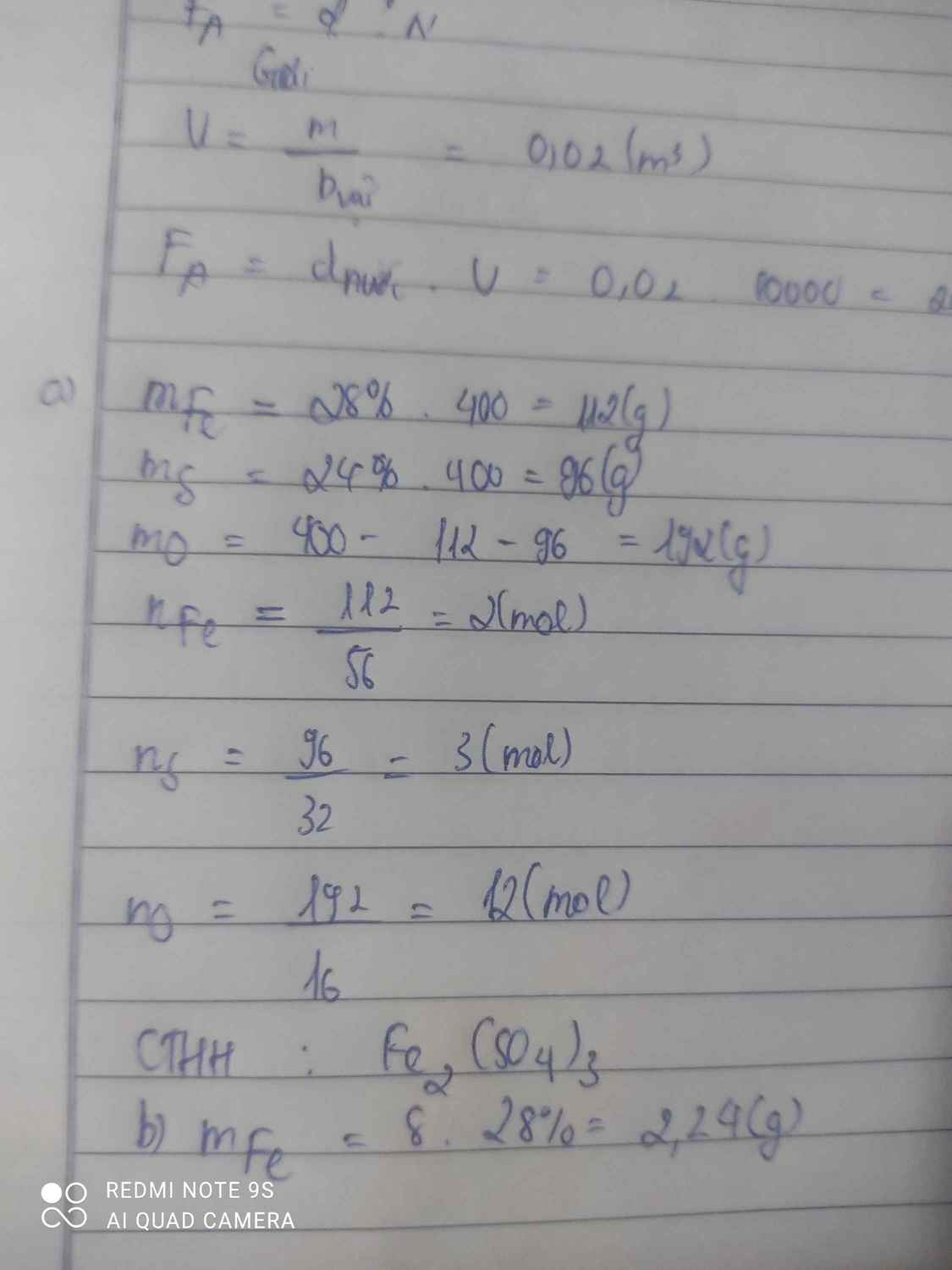
\(\%O=100\%-28\%-24\%=28\%0\)
\(m_{Fe}=\dfrac{28\%.400}{100\%}=112\left(g\right)\Rightarrow n_{Fe}=\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
\(m_S=\dfrac{24\%.400}{100\%}=96\left(g\right)\Rightarrow n_S=\dfrac{m}{M}=\dfrac{96}{32}=3\left(mol\right)\)
\(m_O=\dfrac{48\%.400}{100\%}=192\left(g\right)\Rightarrow n_O=\dfrac{m}{M}=\dfrac{192}{16}=12\left(mol\right)\)
\(\Rightarrow CTHH:Fe_2S_3O_{12}\) hay \(Fe_2\left(SO_4\right)_3\)
Hình như %O sai hay s á bạn