Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(1,PTHH:4Al+3O_2\rightarrow^{t^o}2Al_2O_3\\ \Rightarrow\text{Số nguyên tử Al }:\text{ số nguyên tử O}=4:3\\ 2,\text{Bảo toàn KL: }m_{O_2}=m_{Al_2O_3}-m_{Al}=9,6\left(g\right)\)

\(m_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\Rightarrow V_{O_2}=0,15.24,79=3,7185\left(l\right)\)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Gọi: mO2 = x (g) ⇒ mAl = 1,5x (g)
Theo ĐLBT KL, có: mAl + mO2 = mAl2O3
⇒ 1,5x + x = 10
⇒ x = 4 (g) = mO2
mAl = 1,5.4 = 6 (g)

1. Theo ĐLBT KL, có: mAl + mO2 = mAl2O3
2. \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{Al_2O_3}=0,15\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,15.32=4,8\left(g\right)\)

\(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
Pt : \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,02-->0,015-->0,01
a) \(m_{Al2O3}=0,01.102=1,02\left(g\right)\)
b) \(V_{O2\left(dktc\right)}=0,015.24,79=0,37185\left(l\right)\)
sửa lại \(V_{\left(dktc\right)}-->V_{\left(dkc\right)}\)

a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
c, Theo PT: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)

a) Theo định luật bào toàn khối lượng , ta có :
mAl2O3 = mAl + mO2
b) Ta có :
mAl2O3 = 54 + 48 = 102 (g)
c) %mAl2O3 = \(\frac{102.100}{150}\%=68\%\)
a)
- PTHH: \(Al_2O_3\rightarrow Al+O_2\)
- Công thức về khối lượng: \(m_{Al_2O_3}=m_{Al}+m_{O_2}\)
b)
\(m_{Al_2O_3}=m_{Al}+m_{O_2}\)
hay \(m_{Al_2O_3}=54+48\)
\(\Rightarrow m_{Al_2O_3}=102\left(g\right)\)
c)
Phần trăm: \(m_{Al_2O_3}\) = \(m_{Al_2O_3}\) / m quặng boxit
\(\frac{150}{102}.100\%=1,5\%\)
câu c mk cũng hk chắc nha bạn!!!!!!!!!
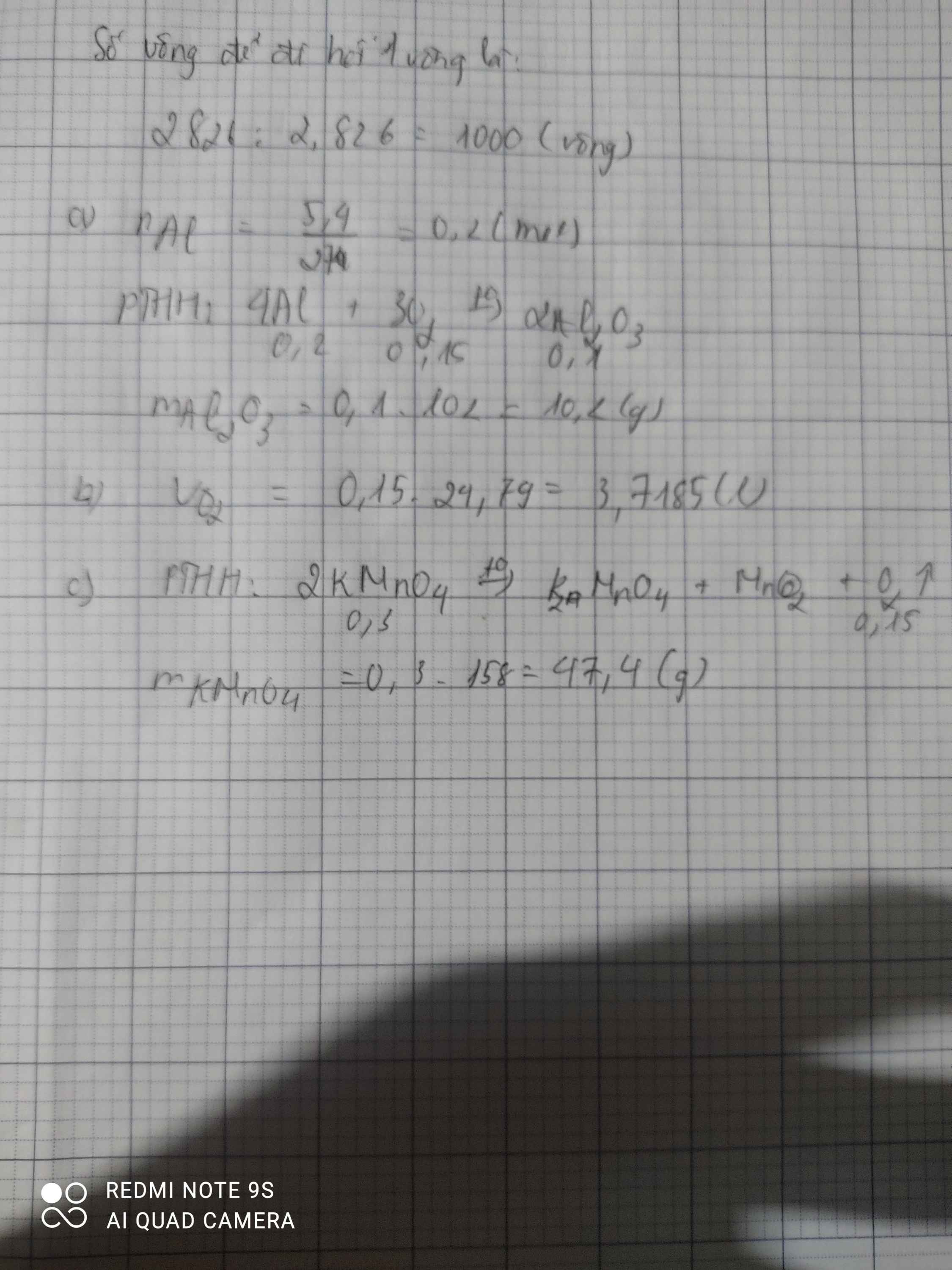
ở 25°C, một dung dịch có chứa 500g AgNO3 trong 250g nước.Tính nồng độ %.Dung dịch AgNO3 có phải dung dịch bão hoà không biết độ tan của AgNO3 trong nước ở nhiệt độ này là 222g/100g nước
Tuyệt vời! Bạn đã đưa ra một bài toán hóa học khá thú vị. Chúng ta cùng giải nhé!
Bài toán:
Ở 25°C, một dung dịch có chứa 500g AgNO₃ trong 250g nước. Tính nồng độ %. Dung dịch AgNO₃ có phải dung dịch bão hòa không? Biết độ tan của AgNO₃ trong nước ở nhiệt độ này là 222g/100g nước.
Giải:
1. Tính khối lượng dung dịch:
Khối lượng dung dịch = Khối lượng chất tan (AgNO₃) + Khối lượng dung môi (nước)
Khối lượng dung dịch = 500g + 250g = 750g
2. Tính nồng độ phần trăm:
Nồng độ phần trăm (C%) = (Khối lượng chất tan / Khối lượng dung dịch) x 100%
C% = (500g / 750g) x 100% = 66,67%
Vậy, nồng độ phần trăm của dung dịch AgNO₃ là 66,67%.
3. Xét xem dung dịch có bão hòa hay không:
Độ tan của AgNO₃ ở 25°C: Nghĩa là trong 100g nước ở 25°C có thể hòa tan tối đa 222g AgNO₃ để tạo thành dung dịch bão hòa.
Dung dịch của chúng ta: Trong 250g nước có 500g AgNO₃. Như vậy, lượng AgNO₃ đã hòa tan nhiều hơn so với lượng tối đa mà 250g nước có thể hòa tan ở 25°C.
Kết luận:
Dung dịch AgNO₃ đã cho là dung dịch chưa bão hòa. Vì lượng AgNO₃ đã hòa tan vượt quá độ tan của nó ở nhiệt độ này.
Tóm lại:
Nồng độ phần trăm của dung dịch AgNO₃ là 66,67%.
Dung dịch AgNO₃ đã cho là dung dịch chưa bão hòa.
Lưu ý:
Dung dịch bão hòa: Là dung dịch chứa lượng chất tan tối đa mà dung môi có thể hòa tan ở một nhiệt độ xác định.
Dung dịch chưa bão hòa: Là dung dịch chưa chứa lượng chất tan tối đa mà dung môi có thể hòa tan.
Hi vọng cách giải này sẽ giúp bạn hiểu rõ hơn về bài toán này nhé!
Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại hỏi nhé!
Chúng ta có thể cùng nhau giải thêm nhiều bài tập hóa học khác nữa!
Chúc bạn học tốt!
bạn nam đạp xe đạp 5 vòng xung quanh 1 công viên hình tròn, tổng quãng đường nam đạp xe quanh công viên dài 1570m .tính diện tích công viên
Để tính được diện tích của công viên hình tròn, trước tiên chúng ta cần tìm bán kính của hình tròn đó.
1. Tìm chu vi của công viên:
Nam đạp xe 5 vòng quanh công viên, vậy quãng đường Nam đạp được trong 1 vòng (cũng chính là chu vi của công viên) là: 1570m ÷ 5 = 314m
2. Tìm bán kính của công viên:
Chúng ta biết công thức tính chu vi hình tròn là: C = 2πr (trong đó C là chu vi, π xấp xỉ 3.14 và r là bán kính).
Từ công thức trên, ta có thể tính được bán kính: r = C ÷ (2π) = 314m ÷ (2 × 3.14) ≈ 50m
3. Tính diện tích của công viên:
Công thức tính diện tích hình tròn là: S = πr² (trong đó S là diện tích).
Thay bán kính vào công thức, ta được: S = 3.14 × 50m × 50m ≈ 7850 m²
Vậy, diện tích của công viên hình tròn là khoảng 7850 mét vuông.
Tóm lại:
Nam đã đạp xe được quãng đường 314m trong 1 vòng quanh công viên.
Bán kính của công viên là khoảng 50 mét.
Diện tích của công viên là khoảng 7850 mét vuông.
Ở điều kiện chuẩn (nhiệt độ 250C, áp suất 1 bar), 1 mol của bất kì chất khí nào đều chiếm một thể tích là
29,74 lít.24,97 lít. 2,497 lít.22,4 lít .
Ở điều kiện chuẩn (nhiệt độ 25°C, áp suất 1 bar), 1 mol của bất kì chất khí nào đều chiếm một thể tích là 24,97 lít.
Giải thích:
Điều kiện chuẩn: Là điều kiện nhiệt độ và áp suất nhất định được các nhà khoa học quy định để so sánh các tính chất của chất khí.
Thể tích mol: Là thể tích chiếm bởi 1 mol của bất kỳ chất khí nào ở điều kiện xác định.
24,97 lít: Đây là giá trị gần đúng của thể tích mol của một chất khí ở điều kiện chuẩn.
Lưu ý:
Có một số tài liệu vẫn sử dụng giá trị 22,4 lít/mol cho thể tích mol của chất khí ở điều kiện tiêu chuẩn (0°C, 1 atm). Tuy nhiên, giá trị chính xác hơn ở điều kiện chuẩn (25°C, 1 bar) là 24,97 lít/mol.
Giá trị thể tích mol của chất khí có thể thay đổi khi thay đổi nhiệt độ và áp suất.
Kết luận:
Ở điều kiện chuẩn, 1 mol của bất kỳ chất khí nào đều chiếm một thể tích xấp xỉ 24,97 lít. Đây là một thông tin quan trọng trong hóa học, giúp chúng ta tính toán các bài toán liên quan đến thể tích khí.
Hòa tan 3 gam muối NaCl vào trong nước thu được dung dịch muối. Chất tan là
Chất tan trong dung dịch muối mà bạn vừa tạo ra là muối ăn (NaCl).
Giải thích:
Dung dịch: Là hỗn hợp đồng nhất của một chất tan trong một dung môi.
Chất tan: Là chất được hòa tan trong dung môi để tạo thành dung dịch. Trong trường hợp này, muối ăn (NaCl) là chất rắn được hòa tan vào nước (dung môi).
Dung môi: Là chất hòa tan chất khác để tạo thành dung dịch. Ở đây, nước là dung môi.
Vậy, khi bạn hòa tan 3 gam muối ăn vào nước, muối ăn chính là chất tan tạo nên dung dịch muối.
Ví dụ: Khi bạn pha một ly nước muối, muối ăn tan hoàn toàn trong nước, tạo thành một dung dịch trong suốt. Muối ăn ở đây đóng vai trò là chất tan.
Tóm lại: Trong dung dịch muối mà bạn vừa tạo ra, chất tan chính là muối ăn (NaCl).
Câu 2. (1,0 điểm) Liệt kê các sự vật gắn bó với môi trường sống và đồng loại. Tình cảm của tác giả thể hiện như thế nào trong văn bản trên? Con ong làm mật, yêu hoa Con cá bơi, yêu nước, con chim ca, yêu trời. Con người muốn sống, con ơi Phải yêu đồng chí, yêu người anh em. Một ngôi sao chẳng sáng đêm Một thân lúa chín, chẳng nên mùa vàng. Một người - đâu phải nhân gian? Sống chăng, một đốm lửa...
Đọc tiếp
Tuyệt vời! Bạn đã chọn một đoạn văn rất hay để phân tích. Chúng ta cùng khám phá nhé!
Câu 2:
a. Liệt kê các sự vật gắn bó với môi trường sống và đồng loại:
Trong thế giới tự nhiên:
Con ong: Yêu hoa
Con cá: Yêu nước
Con chim: Yêu trời
Trong xã hội loài người:
Con người: Yêu đồng chí, yêu người anh em
b. Tình cảm của tác giả thể hiện:
Qua đoạn văn, tác giả thể hiện một tình yêu sâu sắc đối với cuộc sống, với thiên nhiên và với con người. Tác giả muốn khẳng định rằng:
Mọi sinh vật đều có những mối quan hệ gắn kết: Mỗi loài đều có những yêu thương riêng, đều tìm kiếm và gắn bó với những điều phù hợp với bản năng của mình.
Con người không thể sống cô độc: Con người cần có tình yêu thương, sự sẻ chia và gắn kết với đồng loại.
Sự đoàn kết tạo nên sức mạnh: Câu thơ "Một ngôi sao chẳng sáng đêm, Một thân lúa chín chẳng nên mùa vàng" nhấn mạnh tầm quan trọng của sự đoàn kết. Khi chúng ta cùng nhau chung tay, chúng ta sẽ tạo nên những điều lớn lao hơn.
Mỗi cá nhân đều có giá trị: Dù là một ngôi sao nhỏ hay một hạt lúa, mỗi cá nhân đều đóng góp vào sự hoàn thiện của cả một hệ thống.
Tóm lại:
Tác giả muốn gửi gắm thông điệp về tình yêu thương, sự gắn kết và tầm quan trọng của cộng đồng. Ông muốn khẳng định rằng, mỗi cá nhân đều có vai trò quan trọng trong cuộc sống và chúng ta cần sống vì nhau, yêu thương nhau để tạo nên một thế giới tốt đẹp hơn.
Bạn có muốn phân tích sâu hơn về một chi tiết nào đó trong đoạn văn không?
tìm giá trị lớn nhất của biểu thức B=
2020
4
𝑥
+
2
4
x+2
2020
Để tìm giá trị lớn nhất của biểu thức B, chúng ta cần phân tích kỹ hơn về cấu trúc của biểu thức này.
Phân tích biểu thức B:
Mẫu số:
Phần tử thứ nhất: 4x
Phần tử thứ hai: 2(x+2) = 2x + 4
Mẫu số chung: 4x(x+2)
Tử số: 2020
Viết lại biểu thức B dưới dạng tối giản:
B = 2020 / [4x(x+2)]
Để tìm giá trị lớn nhất của B, chúng ta cần:
Mẫu số phải nhỏ nhất: Vì 2020 là một số dương cố định, để B đạt giá trị lớn nhất thì mẫu số phải có giá trị nhỏ nhất.
Mẫu số là một tích: Mẫu số là tích của hai số dương: 4x và (x+2). Để tích này nhỏ nhất, thì cả hai thừa số phải càng gần nhau càng tốt.
Xét các trường hợp:
Nếu x = 0: Mẫu số sẽ bằng 0, biểu thức B không xác định.
Nếu x = -2: Mẫu số sẽ bằng 0, biểu thức B không xác định.
Với các giá trị khác của x: Mẫu số luôn dương.
Kết luận:
Không tồn tại giá trị lớn nhất của biểu thức B.
Biểu thức B có thể đạt giá trị lớn tùy ý bằng cách cho x tiến tới 0 hoặc -2 (nhưng không bằng 0 hoặc -2).
Giải thích:
Khi x tiến tới 0 hoặc -2, mẫu số sẽ tiến tới 0, làm cho giá trị của phân số B trở nên rất lớn. Tuy nhiên, B sẽ không bao giờ đạt được một giá trị lớn nhất cụ thể vì chúng ta luôn có thể tìm được một giá trị x khác gần 0 hoặc -2 hơn để làm cho B lớn hơn nữa.
Tóm lại:
Do đặc điểm của biểu thức B, không tồn tại một giá trị lớn nhất cụ thể cho biểu thức này.
Lưu ý:
Bài toán này liên quan đến khái niệm giới hạn trong toán học. Để hiểu sâu hơn về vấn đề này, bạn có thể tìm hiểu thêm về giới hạn của hàm số.
Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại hỏi nhé!
2^2 . 5 . [(5^2 + 2^3) :11 - 2] - 4^2 . 5
Làm sao giờ mn :)) cứu đi
Để giải bài toán này, chúng ta sẽ thực hiện các phép tính theo thứ tự ưu tiên sau:
Phép tính trong ngoặc:
Tính 5^2 = 25
Tính 2^3 = 8
Tính (25 + 8) = 33
Tính 33 : 11 = 3
Tính 3 - 2 = 1
Phép nhân và chia:
Tính 2^2 = 4
Tính 4^2 = 16
Thay các kết quả vào biểu thức ban đầu: 4 * 5 * 1 - 16 * 5
Phép cộng và trừ:
Tính 4 * 5 = 20
Tính 16 * 5 = 80
Tính 20 - 80 = -60
Vậy kết quả của phép tính là -60.
Tóm tắt các bước tính:
2^2 . 5 . [(5^2 + 2^3) :11 - 2] - 4^2 . 5
= 4 * 5 * [ (25 + 8) : 11 - 2 ] - 16 * 5
= 4 * 5 * [ 33 : 11 - 2 ] - 16 * 5
= 4 * 5 * [ 3 - 2 ] - 16 * 5
= 4 * 5 * 1 - 16 * 5
= 20 - 80
= -60
Hy vọng cách giải này sẽ giúp bạn hiểu rõ hơn nhé!
Nếu bạn còn bất kỳ câu hỏi nào khác, đừng ngần ngại hỏi nhé!
CHO 10.8(g) aluminium (AL) tác dụng hết với khí oxygen thu được aluminium oxide (AL2O3),phản ứng hóa học xảy ra như sau :
AL + O2 ----> AL2O3 .TÍNH V KHÍ O2 CẦN DÙNG Ở 25 ĐỘ C VÀ 1 BAR
TÍNH KHỐI LƯỢNG AL2O3 THU ĐƯỢC
Tuyệt vời! Chúng ta cùng giải bài tập này nhé.
Bước 1: Cân bằng phương trình hóa học:
Để cân bằng phương trình, ta cần có số nguyên tử mỗi nguyên tố bằng nhau ở cả hai vế. Phương trình cân bằng sẽ là:
4Al + 3O₂ → 2Al₂O₃
Bước 2: Tính số mol Al:
Khối lượng mol của Al: M(Al) = 27 g/mol
Số mol Al: n(Al) = m(Al) / M(Al) = 10.8 g / 27 g/mol = 0.4 mol
Bước 3: Tính số mol O₂ theo tỉ lệ phản ứng:
Từ phương trình cân bằng, ta thấy 4 mol Al phản ứng với 3 mol O₂. Vậy 0.4 mol Al sẽ phản ứng với:
n(O₂) = (3 mol O₂ / 4 mol Al) * 0.4 mol Al = 0.3 mol O₂
Bước 4: Tính thể tích O₂ ở điều kiện tiêu chuẩn (25°C, 1 bar):
Ở điều kiện tiêu chuẩn, 1 mol khí chiếm 24.79 lít.
Vậy thể tích O₂ cần dùng: V(O₂) = n(O₂) * 24.79 L/mol = 0.3 mol * 24.79 L/mol ≈ 7.44 L
Bước 5: Tính khối lượng Al₂O₃ thu được:
Khối lượng mol của Al₂O₃: M(Al₂O₃) = 2 * 27 g/mol + 3 * 16 g/mol = 102 g/mol
Từ phương trình cân bằng, ta thấy 4 mol Al tạo ra 2 mol Al₂O₃. Vậy 0.4 mol Al sẽ tạo ra:
n(Al₂O₃) = (2 mol Al₂O₃ / 4 mol Al) * 0.4 mol Al = 0.2 mol Al₂O₃
Khối lượng Al₂O₃ thu được: m(Al₂O₃) = n(Al₂O₃) * M(Al₂O₃) = 0.2 mol * 102 g/mol = 20.4 g
Kết luận:
Thể tích khí O₂ cần dùng ở 25°C và 1 bar là khoảng 7.44 lít.
Khối lượng Al₂O₃ thu được là 20.4 gam.
Lưu ý:
Ở bước 4, chúng ta sử dụng giá trị 24.79 lít/mol cho thể tích mol của một chất khí ở điều kiện tiêu chuẩn (25°C, 1 bar).
Các bước tính toán này dựa trên định luật Avogadro và phương trình hóa học cân bằng
CHO 10.8(g) aluminium (AL) tác dụng hết với khí oxygen thu được aluminium oxide (AL2O3),phản ứng hóa học xảy ra như sau :
AL + O2 ----> AL2O3 .TÍNH V KHÍ O2 CẦN DÙNG Ở 25 ĐỘ C VÀ 1 BAR
TÍNH KHỐI LƯỢNG AL2O3 THU ĐƯỢC