Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình phản ứng:
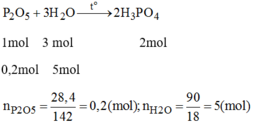
Tỉ lệ mol:
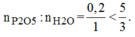
Vậy H 2 O dư và P 2 O 5 hết.
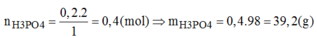
→ Chọn C.

nAl = 0,5 mol
nO2 = 0,3 mol
4Al + 3O2 \(\underrightarrow{t^o}\) 2Al2O3
Đặt tỉ lệ ta có
\(\dfrac{0,5}{4}\) > \(\dfrac{0,3}{3}\)
\(\Rightarrow\) Al dư
\(\Rightarrow\) mAl dư = ( 0,5 - 0,4 ).27 = 2,7 (g)
\(\Rightarrow\) mAl2O3 = 0,2.102 = 20,4 (g)

\(1\\ 2Na + 2H_2O \to 2NaOH + H_2\\ n_{H_2} = \dfrac{1}{2}n_{Na} = \dfrac{1}{2}.\dfrac{4,6}{23} = 0,1(mol)\\ \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\\ 2\\ P_2O_5 + 3H_2O \to 2H_3PO_4\\ n_{H_3PO_4} = 2.n_{P_2O_5} = 2.\dfrac{14,2}{142} = 0,2(mol)\\ \Rightarrow m_{H_3PO_4} = 0,2.98 = 19,6\ gam\)
Câu 1:
PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{NaOH}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\\m_{NaOH}=0,2\cdot40=8\left(g\right)\end{matrix}\right.\)
Câu 2:
PTHH: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Ta có: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_3PO_4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_3PO_4}=0,2\cdot98=19,6\left(g\right)\)

\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ Vì:\dfrac{0,4}{4}< \dfrac{0,53125}{5}\Rightarrow O_2dư\\ n_{O_2\left(dư\right)}=\dfrac{5}{4}.0,4=0,5\left(mol\right)\\ \Rightarrow m_{O_2\left(dư\right)}=32.\left(0,53125-0,5\right)=1\left(g\right)\\ n_{P_2O_5}=\dfrac{2}{4}.0,4=0,2\left(mol\right)\\ \Rightarrow m_{P_2O_5}=142.0,2=28,4\left(g\right)\)

\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\\ a,n_{P_2O_5}=n_{H_2O}:3=0,2:3=\dfrac{1}{15}\left(mol\right)\\ \Rightarrow m_{P_2O_5}=\dfrac{142.1}{15}=\dfrac{142}{15}\left(g\right)\\ b,n_{H_3PO_4}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{H_3PO_4}=98.\dfrac{2}{15}=\dfrac{196}{15}\left(g\right)\)

\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ Vì:\dfrac{0,4}{4}>\dfrac{0,4}{5}\Rightarrow O_2hết\\ n_{P_2O_5}=\dfrac{2}{5}.n_{O_2}=\dfrac{2}{5}.0,4=0,16\left(mol\right)\\ m_{P_2O_5}=0,16.142=22,72\left(g\right)\)
Ta có: \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Xét tỉ lệ: \(\dfrac{0,4}{4}>\dfrac{0,4}{5}\), ta được P dư.
Theo PT: \(n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=0,16\left(mol\right)\Rightarrow m_{P_2O_5}=0,16.142=22,72\left(g\right)\)


PTHH:P2O5+3H2O\(\underrightarrow{t^0}\)2H3PO4
Theo PTHH:142 gam P2O5 cần 54 gam H2O
Vậy:7,1 gam P2O5 cần 2,7 gam H2O
Do đó:P2O5 thừa:28,4-7,1=21,3(gam)
Vì P2O5 thừa nên ta tính SP theo chất thiếu là:H2O
Theo PTHH:54 gam H2O tạo ra 196 gam H3PO4
Vậy:2,7 gam H2O tạo ra 9,8 gam H3PO4
Vậy mH3PO4=9,8 gam
Ta có: \(n_{P_2O_5}=\frac{28,4}{142}=0,2\left(mol\right)\\ n_{H_2O}=\frac{2,7}{18}=0,15\left(mol\right)\)
PTHH: P2O5 + 3H2O -to-> 2H3PO4
Theo PTHH và đề bài, ta có:
\(\frac{0,2}{1}>\frac{0,15}{3}\)
=> P2O5 dư, H2O hết nên tính theo \(n_{H_2O}\)
Theo PTHH và đề bài, ta có:
\(n_{H_3PO_4}=\frac{2.0,15}{3}=0,1\left(mol\right)\)
Khối lượng H3PO4 tạo thành sau phản ứng:
\(m_{H_3PO_4}=0,1.98=9,8\left(g\right)\)