Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì khi đốt cháy X chỉ sinh ra CO2 và H2O
=> CTPT của X gồm có nguyên tố C, H và có thể có O
nO(O2) = 6,5 x 2 = 13 mol
nO(CO2) = 4 x 2 = 8 (mol)
nO(H2O) = 5 mol
Vì nO(O2) = nO(CO2) + nO(H2O)
=> Trong X không có O ( theo định luật bảo toàn số mol nguyên tố)
Đặt CTPT của X là CxHy
Theo định luật bảo toàn số mol nguyên tố:
nC(CO2) = 4 mol = nC(CxHy)
nH(H2O) = 5 x 2 = 10 mol = nH(CxHy)
=> x : y = 4 : 10
=> CTPT: C4H10

Theo đề bài, ta có PTHH:
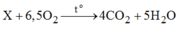
Theo định luật bảo toàn khôi lượng: thì ta có:
1mol chất X phải có 4 mol C ( 4 mol C O 2 ), 10 mol H (5mol H 2 O ) và không chứa oxi ( vì 2 vế của PTHH sô mol nguyên tử oxi bằng nhau). Vậy công thức hóa học của phân tử X là C 4 H 10

X đốt chỉ tạo ra Co2, H2O --> X gồm C, H, có thể có O
nC = 4 mol
nH = 10 mol
nO(X) = 2nCO2 + nH2O - 2nO2 = 2*4 + 5 - 2*6.5 = 0
--> Trong X không có O
Gọi CTTQ của X là CxHy
--> nC = nX*x = x = 4
nH = nX *y = y = 10
--> CTPT là C4H10
câu trả lời chưa đầy đủ vì xét hai trường hợp x có hai hoặc ba nguyên tố sau đó mới làm theo cách của bạn trên

1. Tham Khảo
Vì khi đốt cháy X chỉ sinh ra CO2 và H2O
=> CTPT của X gồm có nguyên tố C, H và có thể có O
nO(O2) = 6,5 x 2 = 13 mol
nO(CO2) = 4 x 2 = 8 (mol)
nO(H2O) = 5 mol
Vì nO(O2) = nO(CO2) + nO(H2O)
=> Trong X không có O ( theo định luật bảo toàn số mol nguyên tố)
Đặt CTPT của X là CxHy
Theo định luật bảo toàn số mol nguyên tố:
nC(CO2) = 4 mol = nC(CxHy)
nH(H2O) = 5 x 2 = 10 mol = nH(CxHy)
=> x : y = 4 : 10
=> CTPT: C4H10
Bài 2 :
nCO2 = 2.24/22.4 = 0.1 mol
=> nC = 0.1 mol
nH2O = 1.8/18 = 0.1 mol
=> nH = 0.2 mol
mO = 3 - 0.1*12 - 0.2 = 1.6 g
nO = 1.6/16= 0.1 mol
Gọi: CTPT của Y : CxHyOz
x : y : z = 0.1 : 0.2 : 0.1 = 1 : 2 : 1
CTTQ : (CH2O)n
M(CH2O)n = 2.68*22.4 = 60
<=> 30n = 60
=> n = 2
Vậy: CTPT của Y :
C2H4O2 hay CH3COOH
CH3 - COOH

1. pthh
CuCO3+ H2O = CuO+ CO2 +H2O
nCO2= 2,22: (12+16.2)= 0,0504 mol
nH2O= 0,9:18= 0,05 mol
nCuO= 6:( 64+16) = o,1125 mol
Vì H20 nhỏ nhất (thiếu) nên các chất phản ứng, các chất tạo thành đều tính theo H2O
Theo pthh: nCuCO3= nH2O= 0.05 mol
mCuCO3= 0,05. (64+16.3)= 5,6g (lượng thu được theo pthh)
gọi lượng thu được thực tế là a, ta co:
a.\(\frac{100}{5,6}\)= 90
a= 5,04
=> khối lượng quặng đem nung là 5,04 g

a)
Do \(\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{1}{2}\)
=> \(\dfrac{n_C}{n_H}=\dfrac{1}{4}\)
Giả sử A có CTHH là CxH4xOy
Gọi số mol của A là a (mol)
=> 12ax + 4ax + 16ay = 3,2
=> ax + ay = 0,2 (1)
Bảo toàn C: nCO2 = ax (mol)
Bảo toàn H: nH2O = 2ax (mol)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn O: \(ay+0,4.2=2ax+2ax\)
=> 4ax - ay = 0,8 (2)
(1)(2) => ax = 0,2 (mol); ay = 0 (mol)
=> A chỉ chứa C và H
\(\left\{{}\begin{matrix}n_C=ax\left(mol\right)\\n_H=4ax\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}m_C=12.ax=2,4\left(g\right)\\m_H=1.4ax=0,8\left(g\right)\end{matrix}\right.\)
b)
Xét \(\dfrac{n_C}{n_H}=\dfrac{1}{4}\)
=> CTPT: (CH4)n
Mà M = 16 g/mol
=> n = 1
=> CTPT: CH4

a,Gọi a (mol)là số mol H2O thì 10a/7 (mol)là số mol của CO2
Áp dụng định luật bảo toàn khối lượng
mNicotin + mO2 = mN2 + mCO2 +mH2O
Hay 6,48+\(\dfrac{12,096}{22,4}\times32\)=1,12+10a/7.44+18a
=>a=0,28
=>mH2O=0,28.18=5,04g
nCO2=(10.0,28)/7=0,4(mol)
b, Theo định luật bảo toàn nguyên tố chấtnicotin có C, N, H và có thể có O
Ta có nC=nCO2=0,4 (mol)
-> mC=0,4.12=4,8(g)
nH=2nH2O=2.0,28=0,56(mol)
mC+mH+mN=4,8+0,56+1,12=6,48
=> Chất nicotin ko có O
nN=1,12:28=0,04(mol)
->CTHH của chất nico tin có dạng: CxHyNz
Ta có:
x:y:z=0,4:0,56:0,04=10:14:2
CTĐGN cuủa chất nicotin là C10H14N2
=> CTPT của chất có dạng (C10H14N2)n
Theo bài ra ta có 122<Mnicotin<203
Hay 122<162n<203
=> n=1
Vậy CTPT của chất nicotin là C10H14N2
Bạn làm thiếu phần a rồi, phải tính Vco2 chứ.
Vco2 = 0,4 * 22,4 = 8,96 (l)

*Sửa đề: "6,72 lít CO2"
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_C=n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\n_H=2n_{H_2O}=2\cdot\dfrac{7,2}{18}=0,8\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{O_2\left(p.ứ\right)}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Ta thấy \(2n_{O_2}< 2n_{CO_2}+n_{H_2O}\) \(\Rightarrow\) Trong A có Oxi
Bảo toàn Oxi: \(n_{O\left(trong.A\right)}+2n_{O_2}=2n_{CO_2}+n_{H_2O}\) \(\Rightarrow n_O=0,1\left(mol\right)\)
Số nguyên tử C trong A là: \(0,3\cdot6\cdot10^{23}=1,8\cdot10^{23}\)
Số nguyên tử H trong A là: \(0,8\cdot6\cdot10^{23}=4,8\cdot10^{23}\)
Số nguyên tử O trong A là: \(0,1\cdot6\cdot10^{23}=6\cdot10^{22}\)
Xét tỉ lệ: \(C:H:O=0,3:0,8:0,1=3:8:1\)
\(\Rightarrow\) CTPT của A là (C3H8O)n
Mà \(M_A=60\) \(\Rightarrow n=1\)
Vậy CTPT của A là C3H8O
Gọi CTPT A là CxHyOz
PTHH: 2CxHyOz + \(\dfrac{4x+y-2z}{2}\)O2 --to--> 2xCO2 + yH2O
______1------->\(\dfrac{4x+y-2z}{4}\)------------->x-------->0,5y
=> \(\left\{{}\begin{matrix}\dfrac{4x+y-2z}{4}=6,5\\x=4\\0,5y=5\end{matrix}\right.=>\left\{{}\begin{matrix}x=4\\y=10\\z=0\end{matrix}\right.\)
=> CTPT: C4H10