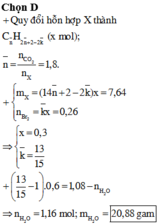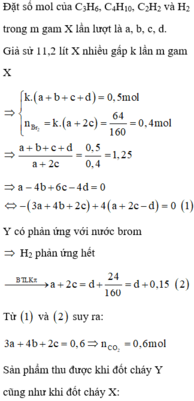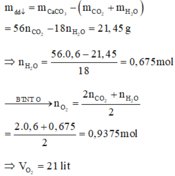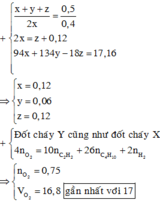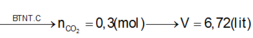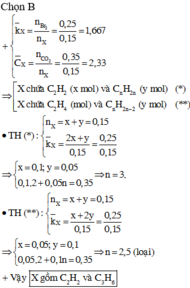Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo giả thiết, Y phản ứng được với dung dịch brom trong CC14. Do đó trong Y còn hidrocacbon không no và H2 phản ứng hết.
Ta có sơ đồ sau:

Áp dụng định luật bảo toàn nguyên tố cho C ta có:
![]()
Có 0,5 mol X

phản ứng vừa đủ với 0,4 mol Br2
Trong đó k là tỉ lệ giữa hỗn hợp X cho tác dụng với dung dịch brom và hỗn hợp X đem đốt cháy.
Ta có: 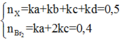
![]()
Nhân 2 vế của (1) với 4 rồi trừ đi (3) ta được:
4(a + 2c - d) - (a - 4b + 6c - 4d) = 4.0,15 - 0 <=> 3a + 4b + 2c = 0,6
Kết hợp với (2) có ![]()
Áp dụng định luật bảo toàn nguyên tố cho nguyên tố C ta có: ![]()
Khi đó khối lượng dung dịch giảm là: ![]()
![]()
Áp dụng định luật bảo toàn nguyên tố cho O, ta có:
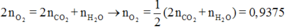
Vậy V = 0,9375.22,4 = 21 (lít)
Đáp án C

Đáp án A
● Cách 1: Tính toán theo phương trình phản ứng
Theo giả thiết, suy ra : Y gồm C 2 H 2 , C 2 H 4 , C 2 H 6 và có thể có H 2 . Z có C 2 H 6 và có thể có H 2 .
Dựa vào số mol của các chất Br2, C2Ag2, CO 2 , H 2 O và bản chất phản ứng, ta có :
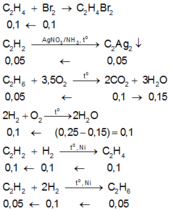
Suy ra :
n H 2 trong X = 0 , 3 ; n C 2 H 2 trong X = 0 , 2 V X đktc = V C 2 H 2 + V H 2 = 11 , 2 lít
● Cách 2: Sử dụng phương pháp bảo toàn nguyên tố
Theo giả thiết, suy ra :
n C 2 H 2 dư = n C 2 Ag 2 = 0 , 05 ; n C 2 H 4 = n Br 2 = 0 , 1 ; n H 2 O = 0 , 25
Nhận xét : Các chất trong X đều chứa 2 nguyên tử H. Mặt khác, số mol của C 2 H 2 dư, C 2 H 4 và H 2 O đều đã biết. Vậy áp dụng bảo toàn nguyên tố H là tính được số mol của hỗn hợp X. Vì thế không mất nhiều thời gian viết phương trình phản ứng và tính toán như cách 1.
Áp dụng bảo toàn nguyên tố đối với H, ta có :
2 n H 2 + n C 2 H 2 ⏟ n X = 2 n C 2 H 2 dư ⏟ 0 , 05 + 4 n C 2 H 4 ⏟ 0 , 1 + 2 n H 2 O ⏟ 0 , 25 ⇒ n X = 0 , 5 mol ⇒ V X đktc = 11 , 2 lít