Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì nitrogen có nhiều electron nên tương tác London tăng, nhiệt độ nóng chảy, nhiệt độ sôi tăng. Vậy nên đơn chất N2 khó hoá lỏng và ít tan trong nước (không phân cực).

1. Cấu hình electron của nguyên tử sulfur là: 1s22s22p63s23p4.
Cấu hình electron theo ô orbital:
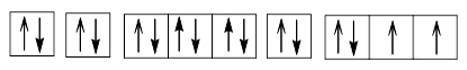
2. a) Ở trạng thái cơ bản S có 2 electron độc thân; ở trạng thái kích thích S có 4 hoặc 6 electron độc thân. Bởi vậy, trong hợp chất của S với các nguyên tố có độ âm điện nhỏ hơn S có số oxi hoá -2; trong các hợp chất cộng hoá trị của S với các nguyên tố có độ âm điện lớn hơn, nguyên tố S có số oxi hoá +4 hoặc +6.
⇒ Trong hợp chất, số oxi hoá thấp nhất của S là -2; số oxi hoá cao nhất của S là +6.
b) Khi tham gia phản ứng hoá học S thể hiện tính oxi hoá hoặc tính khử do đơn chất S (số oxi hoá = 0) có số oxi hoá trung gian giữa -2 và +6.

Đáp án C
(1) Sai vì axit béo no là chất rắn, axit béo không no là chất lỏng -> axit béo no có nhiệt độ nc cao hơn axit béo k no
(2) Đúng vì ancol và axit có lk H còn este thì k có tính chất này
(3) Đúng
(4) Sai vì fructozo trong dd chủ yếu tồn tại ở dạng beta, vòng 5 hoặc 6 cạnh
(5) Đúng
(6) Đúng

Các số oxi hóa có thể có của sulfur: -2; 0; +2; +4; +6.
Vì +6 là số oxi hóa lớn nhất của sulfur, do đó trong các phản ứng oxi hóa khử, số oxi hóa của sulfur chỉ có thể giảm về +4 (hoặc +2; 0; -2). Vậy H2SO4 không có khả năng thể hiện tính khử, mà chỉ thể hiện tính oxi hóa.
Trong tinh thể sulfur, các phân tử S8 tương tác với nhau bằng lực van der Waals yếu do đó đơn chất sulfur có nhiệt độ nóng chảy thấp, sulfur nóng chảy ở nhiệt độ 113oC.