Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl \(\rightarrow\) MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl \(\rightarrow\)2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl \(\rightarrow\)2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 \(\rightarrow\) nmol Cl2
Theo (2) nmol KMnO4 \(\rightarrow\) 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 \(\rightarrow\) 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
Clo oxi hóa dễ dàng Br – tronh dung dịch muối bromua và I- trong dung dịch muối iotua.
Cl2 + 2NaBr \(\rightarrow\) 2NaCl + Br2
Cl2 + 2NaI \(\rightarrow\) 2NaCl + I2

Ta có bảng sau khi điền
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương |
Sản phẩm ở cực âm |
|
Khí oxi |
H2O pha thêm H2SO4 |
Khí oxi |
Khí hiđro |
|
Khí clo |
NaCl (có màng ngăn) |
Khí clo |
Khí hiđro |
Phương trình điện phân :
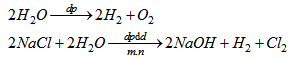

Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)

Xét hiệu độ âm điện của các phân tử :
\(H_2\): \(2,20-2,20=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(O_2\): \(3,44-3,44=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(O_3\): \(3,44-3,44=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(H_2O\): \(3,44-2,20=1,24>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(BeCl_2\): \(3,16-1,57=1,59>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CO\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CO_2\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(NH_3\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(PH_3\): \(2,20-2,19=0,01< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(BF_3\): \(3,98-2,04=1,94>1,7\text{ }\Rightarrow\) Liên kết ion.
\(HF\): \(3,98-2,20=1,78>1,7\text{ }\Rightarrow\) Liên kết ion.
\(HCl\): \(3,16-2,20=0,96>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(N_2\): \(3,04-3,04=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(NO\): \(3,44-3,04=0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.

Xét hiệu độ âm điện :
\(P_2O_5\): \(3,44-2,19=1,25>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HAt\): \(2,20-2,2=0< 0,4\text{ }\Rightarrow\)Liên kết cộng hoá trị không cực.
\(C_3O_2\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CsF\): \(3,98-0,79=3,19>1,7\text{ }\Rightarrow\) Liên kết ion.
\(NaCl\): \(3,16-0,93=2,23>1,7\text{ }\Rightarrow\) Liên kết ion.
\(CaO\): \(3,44-1,00=2,44>1,7\text{ }\Rightarrow\) Liên kết ion.
\(PN\): \(3,04-2,19=0,85>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(ClF_3\): \(3,98-3,16=0,82>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.

Đơn chất nào sau đây vừa có tính oxi hóa, vừa có tính khử ?
A. Cl2, O3, S.
B. S, Cl2, Br2.
C. Na, F2, S.
D. Br2, O2, Ca.

Lời giải.
a) Khí hiđro sunfua H2S và khí lưu huỳnh đioxit SO2 không cùng tồn tại trong một bình chứa vì H2S là chất khử mạnh, SO2 là chất oxi hóa.
2H2S + SO2 -> 3S + 2H2O.
b) Khí oxi O2 và khí Cl2 có thể tồn tại trong một bình chứa vì O2 không tác dụng trực tiếp với Cl2.
c) Khí HI và Cl2 không tồn tại trong cùng một bình chứa vì Cl2 là chất oxi hóa mạnh và HI là chất khử mạnh.
Cl2 + 2HI -> 2HCl + I2.
Chọn đáp án B
Trong phòng thí nghiệm, khí clo được điều chế bằng cách dung chất oxi hóa mạnh oxi hóa HCl.