Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl \(\rightarrow\) MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl \(\rightarrow\)2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl \(\rightarrow\)2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 \(\rightarrow\) nmol Cl2
Theo (2) nmol KMnO4 \(\rightarrow\) 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 \(\rightarrow\) 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
Clo oxi hóa dễ dàng Br – tronh dung dịch muối bromua và I- trong dung dịch muối iotua.
Cl2 + 2NaBr \(\rightarrow\) 2NaCl + Br2
Cl2 + 2NaI \(\rightarrow\) 2NaCl + I2

sao chị ko đáp lại câu trả lời của em ở câu trước , chị ko biết hả ?

a/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(3Cl_2+2Fe\underrightarrow{^{to}}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(2NaCl+H_2SO_4\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(HCl+CuO\rightarrow CuCl_2+H_2O\)
\(CuCl_2+AgNO_3\rightarrow AgCl+Cu\left(NO_3\right)2\)
b/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2Na\underrightarrow{^{to}}2NaCl\)
\(2NaCl+H_2SO_{4_{dac}}\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(2HCl+Fe\rightarrow FeCl_2+H_2\)
c/
\(MnO_2+4HCl_đ\underrightarrow{^{to}}MnO_2+Cl_2+2H_2O\)
\(Cl_2+2K\underrightarrow{^{to}}2KCl\)
\(2KCl+H_2SO_4\underrightarrow{^{to}}K_2SO_4+2HCl\)
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Br_2+2NaI\rightarrow NaBr+I_2\)
d/
\(2KMnO_4+16HCl_đ\underrightarrow{^{to}}2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(Cl_2+H_2\underrightarrow{^{as}}2HCl\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3AgNO_3\rightarrow3AgCl+Fe\left(NO_3\right)_3\)

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl → 2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 → nmol Cl2
Theo (2) nmol KMnO4 → 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 → 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
a) Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl → 2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 → nmol Cl2
Theo (2) nmol KMnO4 → 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 → 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)

Đáp án D
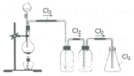
Để loại bỏ tạp chất người ta dẫn khí clo lần lượt qua các bình:
Bình đựng dung dịch NaCl bão hòa để loại khí hiđro clorua (HCl)
Bình đựng H2SO4 đặc để loại bỏ hơi nước.

a)
HX là chất HCl.
$NaCl + H_2SO_{4\ đặc} \xrightarrow{t^o} HCl + NaHSO_4$
HX không thể là HI hay HBr vì $H_2SO_4$ đặc oxi hoá được chúng tạo ra $I_2$ và $Br_2$
b) Không thể dùng dung dịch $NaCl$ và $H_2SO_4$ loãng để điều chế $HCl$ do HCl là chất tan rất tốt trong nước nên khí HCl sinh ra nếu có nước trong dung dịch HCl sẽ tan vào trong nước tạo ra dung dịch axit
Mặt khác, $H_2SO_4$ đặc có vai trò hút ẩm, hút nước

\(n_{KMnO_4}=\frac{15,8}{158}=0,1\left(mol\right)\)
PTHH : \(2KMnO_4+16HCl-->2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(Cl_2+H_2-as->2HCl\) (2)
Có : \(m_{ddHCl}=100\cdot1,05=105\left(g\right)\)
=> \(m_{HCl}=105-97,7=7,3\left(g\right)\)
=> \(n_{HCl}=\frac{7,3}{36,5}=0,2\left(mol\right)\)
BT Clo : \(n_{Cl_2}=\frac{1}{2}n_{HCl}=0,1\left(mol\right)\)
Mà theo lí thuyết : \(n_{Cl_2}=\frac{5}{2}n_{KMnO_4}=0,25\left(mol\right)\)
=> \(H\%=\frac{0,1}{0,25}\cdot100\%=40\%\)
Vì spu nổ thu được hh hai chất khí => \(\hept{\begin{cases}H_2\\HCl\end{cases}}\) (Vì H2 dư)
=> \(n_{hh}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
=> \(n_{H_2\left(spu\right)}=n_{hh}-n_{HCl\left(spu\right)}=0,6-0,2=0,4\left(mol\right)\)
BT Hidro : \(\Sigma_{n_{H2\left(trong.binh\right)}}=n_{H_2\left(spu\right)}+\frac{1}{2}n_{HCl}=0,4+0,1=0,5\left(mol\right)\)
đọc thiếu đề câu a wtf
\(C_{M\left(HCl\right)}=\frac{0,2}{0,1}=2\left(M\right)\)

Đáp án C