Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt t=1g
ta có :
\(\text{p=0,71}\)
\(\frac{\text{ (m+0,71)}}{\text{1,02}}=1\rightarrow\text{m=0,31}\)
Đặt công thức là CxHyOz
\(\text{CxHyOz+O2}\rightarrow\text{CO2+H2O}\)
\(\text{nCaCO3=}\frac{1}{100}\text{=0.01=nCO2}\rightarrow\text{mCO2=0,44, mC=0,12}\)
\(\rightarrow\text{mH2O=0,71-0,44=0,27}\)
\(\rightarrow\text{nH2O=0,015}\)
\(\rightarrow\text{mH=0,03}\)
mO=0,31-0,12-0,03=0,16\(\rightarrow\)nO=0,01
\(\text{x:y:z=nC:nH:nO=0,01:0,03:0,01}\)
\(\rightarrow\)CTPT:C2H6O2

TN1. nKOH = 0,22 mol
2KOH + ZnSO4 → Zn(OH)2 + K2SO4 (1)
2KOH + Zn(OH)2 → K2ZnO2 + 2H2O (2)
Gọi x là số mol của Zn(OH)2 phản ứng ở pt (2)
ð Số mol của Zn(OH)2 tạo ra ở pt (1) là \(x+\frac{3a}{99}\); nKOH = 2x + \(2\left(x+\frac{3a}{99}\right)\)= 0,22 mol (1')
TN2. nKOH = 0,28 ; Lượng KOH ở thí nghiệm 2 lớn hơn TN1 là 0,28 – 0,22 = 0,06 mol.
Tương tự như trên ta có: nKOH = (2x + 0,06) + \(2\left(x+0,03+\frac{2a}{99}\right)\)= 0,28 mol (2')
Từ (1') và (2') => x = 0,01 ; a = 2,97 ==> nZnSO4 = = 0,1 mol => mZnSO4 = 161.0,1 = 16,1g
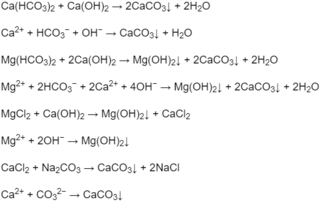


4.