Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) nNaOH=CM.V=0,5.0.4=0,2 mol
=> nOH-=0,2mol
H++ OH- =>H2O
=> nH+=0,2 mol
=> [H+]= n:V=0,2:1=0,2M
Gọi x,y lần lượt là số mol của Cl-, SO42-
mmuối= mNa++mCl-+mSO42-=0,2.23+35,5x+96y=12,95
=> 35,5x+96y=8,35(1)
Áp dụng định luật bảo toàn điện tích:
1.Cl-+2.SO42-=1.H+
=> 1.x+2.y=0,2.1
=> x+2y=0,2 (2)
Từ (1)(2)=> x=0,1; y=0,05
=> Số mol của Cl- và SO42- lần lượt là 0,1 và 0,05 mol
=> [Cl-]=n:V=0,1:1=0,1M
[SO42-]= n:V=0,05:1=0,05M
b) pH= -log0,2= 0,7

Đáp án B
H2SO4 → 2H++ SO42-
x M 2x M
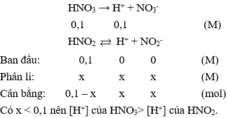
HNO3→ H++ NO3-
x M xM
HNO2 ⇌H++ NO2-
< x M

PT phân li: CH3COOH \(\rightarrow\) CH3COO- + H+
Ban đầu: Co
Phân li: \(\alpha\)Co....................\(\alpha\)Co..........\(\alpha\)Co
Còn lại: Co(1-\(\alpha\))..............\(\alpha\)Co..........\(\alpha\)Co
(\(\alpha\): hằng số phân li; Co: nồng độ ban đầu của axit)
Ta có [H+] = \(\alpha Co=0,001\Rightarrow Co=\dfrac{0,001}{2\%}=0,05M\)
\(n_{HNO_2}=\dfrac{5,64.10^{19}}{6.10^{23}}=9,4.10^{-5}\)
\(n_{NO_2^-}=\dfrac{3,6.10^{18}}{6.10^{23}}=6.10^{-6}\)
\(HNO_2⇌H^++NO_2^-\)
Ta có :
\(n_{HNO_2}=9,4.10^{-5}+6.10^{-6}=10^{-4}\)
Độ điện li \(\alpha=\dfrac{6.10^{-6}}{10^{-4}}=0,06\)
b)
\(C_{M_{HNO_2}}=\dfrac{10^{-4}}{10^{-3}}=0,1M\)
cảm ơn ạ