Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

chứa % tạp chất vậy đó là bao nhiêu phần trăm em ơi?

2Al2O3\(\rightarrow\) 4Al + 3O2
mAl2O3= \(\frac{1000.20}{100}\)=200(kg)
Theo PTHH: mAl= 400(kg)
Vì có chứa 1,5% tạp chất
\(\rightarrow\)mAl thu được là trên lí thuyết là \(\frac{\text{400 - 400.1,5}}{100}\)=394(kg)
vì H=95% \(\Rightarrow\) mAl thực tế thu được là \(\frac{\text{394.95}}{100}\)=374,3(kg)

a/ nAl= 54/27= 2(mol)
nO2=48/32=1,5(mol)
PTHH: 2 Al2O3 -to-> 4 Al +3 O2
Ta có: 2/4 = 1,5/3
=> P.ứ hết
=> nAl2O3= 1/2. nAl=1/2. 2=1(mol)
=> mAl2O3=1.102=102(g)
b) %mAl2O3= (102/127,5).100= 80%

a) 2Al2O3 --------> 4 Al + 3O2
b) Theo ĐLBTKL, ta có khối lượng của Al2O3 bị phân hủy là:
mAl2O3 = mAl+ mO2
= 5,4+ 4,8= 10,2 (g)
c) % tạp chất trong quặng trên là:
100- ( \(\frac{10,2}{20,4}\). 100)= 50%

Nửa tấn=500000g
2Al2O3-->4Al+3O2
Khối lượng Al2O3 nguyên chất trong nửa tấn quặng bô-xít là
500000.50%=250000(g)
Số mol của Al2O3 là
n=m/M=250000/102
=125000/51(mol)
Số mol của Al là
nAl=2nAl2O3=2.125000/51
=250000/51(mol)
Khối lượng của Al là
m=n.M=250000/51.27
=2250000/17( g)
Khối lượng của Al nguyên chất là
2250000/17-
(2250000/17.1.5%)
=2216250/17(g)

a) \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
______0,3--------------->0,15
=> \(m_{Al_2O_3\left(PTHH\right)}=0,15.102=15,3\left(g\right)\)
=> mAl2O3 (thực tế) = \(\dfrac{15,3.100}{90}=17\left(g\right)\)

trong 0,5 tấn quặng có chứa: 50%*0,5=0,25 tấn Al2O3
theo lí thuyết thì mAl thu được = 0,25*2*27/102=9/68 tấn
H=90% ==> mAl thu được =81/680 tấn ~0,12 tấn
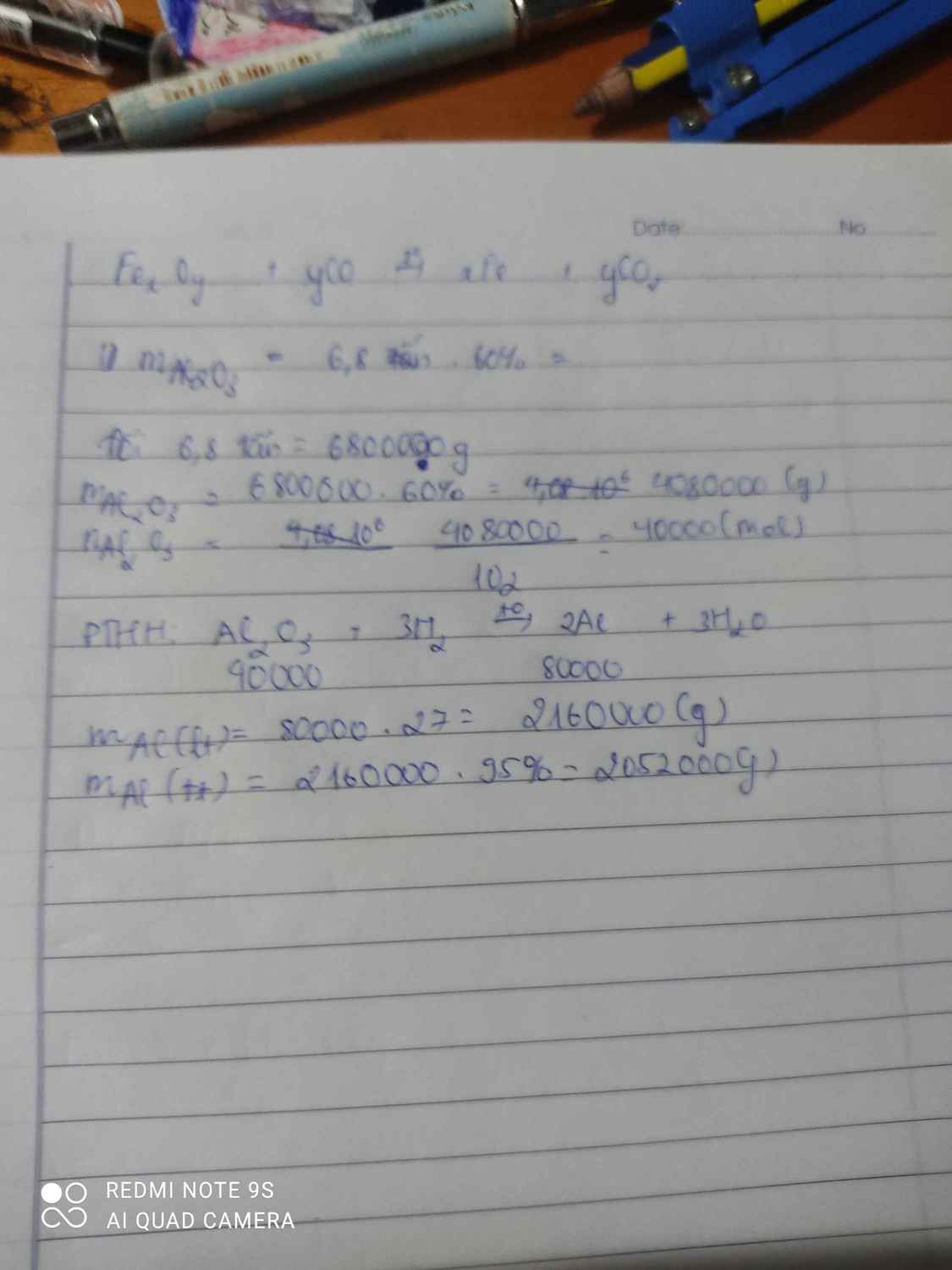
PTHH
2Al2O3 \(\rightarrow\) 4Al + 3O2
mAl2O3(ĐB) = 50% x 0,5 = 0,25(tấn)
H = mAl2O3(PƯ) : mAl2O3(ĐB) x 100% = 90%
=> mAl2O3(PƯ) : 0,25 =0,9
=> mAl2O3(PƯ) = 0,9 x 0,25 =0,225(tấn)
Theo PT : 204g Al2O3 : 108g Al
Theo ĐB : 0,225 tấn Al2O3 : x tấn Al
=> x = 0,225 x 108 : 204 = 81/680 (tấn)
mà nhôm luyện từ oxit đó có chứa 1,5% tạp chất
=> %mAl(tinh khiết) = 100% - 1,5% =98.5%
=> mAl(tinh khiết) = 98,5% x 81/680 =0,1173(tấn)
0,5 tấn=500000g
\(m_{Al_2O_3\left(khôngtinhkhiet\right)}=\frac{500000.50}{100}=250000\left(g\right)\)
\(m_{Al_2O_2\left(tinhkhiet\right)}=250000-\left(\frac{250000.1,5}{100}\right)=246250\left(g\right)\)
\(2Al_2O_3\underrightarrow{t^o}4Al+3O_2\)
\(n_{Al_2O_3}=\frac{246250}{102}=\frac{123125}{51}\left(mol\right)\)
\(n_{Al}=2.n_{Al_2O_3}=2.\left(\frac{123125}{51}\right)=\frac{246250}{51}\left(mol\right)\)
\(m_{Al\left(lt\right)}=\frac{246250}{51}.27=130367,6471\left(g\right)\)
\(m_{Al\left(thucte\right)}=\frac{130367,5471.90}{100}=117330,8824\left(g\right)=0,11733\left(tấn\right)\)