Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

| Lương Tuấn Dũng | +1đ điểm giá trị | |
| Thứ 4, ngày 20/09/2017 22:07:04 | |
| Chat Online |
+nNaOH=0.1*0.3=0.03(mol)=nOH{-}
+nBa(OH)2=0.025*0.3=0.0075(mol)
=>nOH{-}=0.0075*2=0.015(mol)
=>nOH{-}(tổng)=0.03+0.015=0.045(mol)
+nH2SO4=0.2x(mol)
=>nH{+}=0.2x*2=0.4x(mol)
_Sau phản ứng thu được dd có pH=2=>môi trường có tính axit.
+[H+] dư=10^-2M
_Vdd(sau)=300+200=500(ml)=0.5(lit)
=>nH{+} dư=10^-2*0.5=0.005(mol)
H{+}+OH{-}=>H2O
0.4x->0.045...........(mol)
0.045->0.045........(mol)
0.4x-0.045->0........(mol)
=>nH{+} dư=0.4x-0.045(mol)
<=>0.4x-0.045=0.005
<=>0.4x=0.05
<=>x=0.125M
Vậy [H2SO4]=0.125M
_Sau phản ứng thu được kết tủa BaSO4:
+nBa{2+}=nBa(OH)2=0.0075(mol)
+nSO4{2-}=0.2*0.125=0.025(mol)
Ba{2+}+SO4{2-}=>BaSO4
0.0075<0.025---->0.0075(mol)
=>mBaSO4=0.0075*233=1.7475(g) Tham khảo nha
+nNaOH=0.1*0.3=0.03(mol)=nOH{-}
+nBa(OH)2=0.025*0.3=0.0075(mol)
=>nOH{-}=0.0075*2=0.015(mol)
=>nOH{-}(tổng)=0.03+0.015=0.045(mol)
+nH2SO4=0.2x(mol)
=>nH{+}=0.2x*2=0.4x(mol)
_Sau phản ứng thu được dd có pH=2=>môi trường có tính axit.
+[H+] dư=10^-2M
_Vdd(sau)=300+200=500(ml)=0.5(lit)
=>nH{+} dư=10^-2*0.5=0.005(mol)
H{+}+OH{-}=>H2O
0.4x->0.045...........(mol)
0.045->0.045........(mol)
0.4x-0.045->0........(mol)
=>nH{+} dư=0.4x-0.045(mol)
<=>0.4x-0.045=0.005
<=>0.4x=0.05
<=>x=0.125M
Vậy [H2SO4]=0.125M
_Sau phản ứng thu được kết tủa BaSO4:
+nBa{2+}=nBa(OH)2=0.0075(mol)
+nSO4{2-}=0.2*0.125=0.025(mol)
Ba{2+}+SO4{2-}=>BaSO4
0.0075<0.025---->0.0075(mol)
=>mBaSO4=0.0075*233=1.7475(g)

Có:nH2SO4 =0,02(mol) ; nHCl=0,04(mol)
=>nH(+)=0,08(mol)
Có: nBa(OH)2 =0,045 (mol); nNaOH=0,03(mol)
=>nOH(-)=0,12(mol)
H(+) +OH(-) ------>H2O
0,008-----0,008
=>nOH(-) dư=0,04(mol)
[OH(-) dư]=0,04/0,5=0,08(M)
=>pH= -log(0,08) =1,1

Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2

\(n_{HCl}=0,1.0,1=0,01\left(mol\right);n_{HCl}=0,3.0,04=0,012\left(mol\right)\)
Dung dịch gồm H+ và Cl-
\(n_{H^+}=0,01+0,012=0,022\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,022}{0,4}=0,055M\)
\(n_{Cl^-}=0,01+0,012=0,022\left(mol\right)\)
=>\(\left[Cl^-\right]=\dfrac{0,022}{0,4}=0,055M\)
Trộn 100ml dung dịch HNO3 0.1M với 400ml dung dịch H2SO4 0.03M
\(n_{HNO_3}=0,1.0,1=0,01\left(mol\right);n_{H_2SO_4}=0,04.0,3=0,012\left(mol\right)\)
Dung dịch sau khi trộn gồm :
\(n_{H^+}=0,01+0,012.2=0,034\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,034}{0,5}=0,068M\)
\(n_{NO_3^-}=0,01\left(mol\right)\)
=>\(\left[NO_3^-\right]=\dfrac{0,01}{0,5}=0,02M\)
\(n_{SO_4^{2-}}=0,012\left(mol\right)\)
=> \(\left[SO_4^{2-}\right]=\dfrac{0,012}{0,5}=0,024M\)

a, \(\left[Na^+\right]=0,1\)
\(\left[K^+\right]=0,1\)
\(\left[OH^-\right]=0,2\)
\(\left[SO_4^{2-}\right]=0,2\)
\(\left[H^+\right]=0,4\)
b, \(n_{H^+}=0,1.0,4=0,04\left(mol\right)\)
\(n_{OH^-}=0,1.0,2=0,02\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(\Rightarrow n_{H^+dư}=0,02\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,02}{200}=10^{-4}\)
\(\Rightarrow pH=4\)

$n_{NaOH} = n_{KOH} = 0,1.0,1 = 0,01(mol)$
$n_{H_2SO_4} = 0,02(mol)$
OH- + H+ → H2O
Bđ : 0,01...0,04..................(mol)
Pư : 0,01...0,01...................(mol)
Sau pư : 0......0,03...................(mol)
$V_{dd} = 0,1 + 0,1 = 0,2(lít)$
Vậy :
$[K^+] = [Na^+] = \dfrac{0,01}{0,2} = 0,05M$
$[H^+] = \dfrac{0,03}{0,2} = 0,15M$
$[SO_4^{2-}] = \dfrac{0,02}{0,2} = 0,1M$
b)
$pH = -log(0,15) = 0,824$

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

nOH-=0,05.2.0,2+ 0,1.0,2=0,04 mol
nH+=0,1.V.2+ 0,2.V=0,4V mol
H++OH--->H2O
nH+=nOH-=> 0,4v=0,04-> v=0,1 lit = 100ml
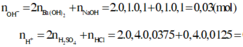
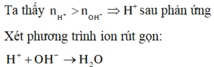
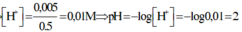
\(pH=2\Rightarrow\left[H^+_{dư}\right]=10^{-2}\Rightarrow n_{H^+}=10^{-2}\left(V+0,4\right)\)
\(n_{H^+}=2.0,0375.0,4+0,0125.0,4=0,035\left(mol\right)\)
\(n_{OH^-}=0,3V\left(mol\right)\)
\(\Rightarrow0,035+0,3V=10^{-2}\left(V+0,4\right)\)
\(\Rightarrow V=33,1\left(l\right)\)
\(\Leftrightarrow V=\)