Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

B
X và Y là hai kim loại cùng nhóm A.
=> Y có nhiều hơn X là 8 hoặc 18 hoặc 32 electron.
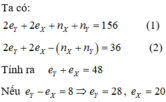
(không thuộc 2 chu kì)(loại).
![]()
Vậy 2 nguyên tố này là As và P, cùng thuộc nhóm VA và thuộc 2 chu kì (nhận).
![]()
(không thuộc 2 chu kì liên tiếp) (loại).
Vậy X là photpho (P).

Đáp án C
Theo đề bài, ta có: ZX + ZY = 22 (1)
- Nếu X, Y thuộc hai chu kì nhỏ thì (ZX < ZY): ZY = ZX + 8 (2)
Từ (1) và (2) => ZX =7; ZY = 15.
Vậy X là N, Y là P
- Nếu X thuộc chu kì nhỏ và Y thuộc chu kì lớn thì: ZY = ZX + 18 (3)
Từ (1) và (3) => ZX = 2; ZY = 20 (loại vì không thảo mãn đề bài)
- Nếu X, Y thuộc hai chu kì lớn: ZY = ZX + 32 (4)
Từ (1) và (4) => ZX <0 (loại)

Đáp án D
Hai nguyên tố thuộc cùng một nhóm A, thuộc hai chu kỳ liên tiếp = Điện tích hạt nhân cách nhau 8, 18 hay 32
Trường hợp 1:
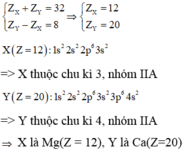
Trường hợp 2:
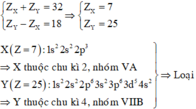
Trường hợp 3:
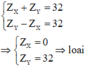

Zx+zy=51
Hai nhóm liên kết nhau ở chu kỳ 4
=> TH1: zy-zx=1
=>TH2: zy-zx=11




\(2P_X+6P_Y+2=82\Rightarrow P_X+3P_Y=40\)
Mặt khác X và Y thuộc cùng 1 phân nhóm chính và ở hai chu kì liên tiếp nhau nên sẽ có:\(\left[{}\begin{matrix}P_X-P_Y=2\\P_X-P_Y=8\\P_X-P_Y=18\\P_X-P_Y=32\end{matrix}\right.\)
Xét TH
TH1 \(\left\{{}\begin{matrix}P_X+3P_Y=40\\P_Y-P_X=2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P_Y=11.5\\P_X=9.5\end{matrix}\right.\)(LOẠI)
TH2 \(\left\{{}\begin{matrix}P_X+3P_Y=40\\P_Y-P_X=8\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P_Y=16\\P_X=8\end{matrix}\right.\)(TM)
TH2\(\left\{{}\begin{matrix}P_X+3P_Y=40\\P_Y-P_X=18\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P_Y=23.5\\P_X=5.5\end{matrix}\right.\)(LOẠI)
TH4 \(\left\{{}\begin{matrix}P_X+3P_Y=40\\P_Y-P_X=32\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P_Y=34\\P_X=2\end{matrix}\right.\)(LOẠI)
Vậy X là nguyên tố S (lưu huỳnh)
đề thiếu bạn ơi chưa cho tổng số hạt mang điện ạ