Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có \(\left\{{}\begin{matrix}2p+n-3=79\\2p-n-3=19\end{matrix}\right.=>\left\{{}\begin{matrix}p=e=26\\n=30\end{matrix}\right.\)
Cấu hình: [Ar]3d64s2
=> A

\(Tacó:\left\{{}\begin{matrix}2Z+N-3=79\\2Z-N-3=19\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}Z=26\\N=30\end{matrix}\right.\\Z=26\Rightarrow Cấuhìnhe:\left[Ar\right]3d^64s^2 \\ \Rightarrow ChọnB\)

a, Ta có: P + N + E = 34
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 34 (1)
Theo đề, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=11=Z\\N=12\end{matrix}\right.\) ⇒ A = 11 + 12 = 23
→ KH: \(^{23}_{11}X\)
b, Cấu hình e: 1s22s22p63s1
Cấu hình e theo orbital:
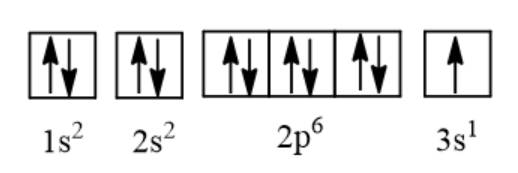
c, X có 1 e hóa trị → tính kim loại
d, - Z = 11 → ô số 11
- Có 3 lớp e → chu kỳ 3
- e cuối cùng phân bố ở phân lớp s, có 1 e hóa trị → nhóm IA
Vậy: X thuộc ô số 11, chu kỳ 3, nhóm IA

\(\begin{cases} 2Z_A+n_A=34\\ 2Z_A-n_A=10 \end{cases} ⇒ \begin{cases} Z_A=11 (Na)\\ n_A=12 \end{cases} \)
\(Z_A-Z_B=2 ⇒ Z_B=9 (F)\)
\(⇒\) Vậy hợp chất AB là NaF, thuộc loại liên kết ion, do Na, F lần lượt là kim loại và phi kim điểm hình.

X có số khối A = 67, số proton = số eletron = 18 + 10 + 2 = 30.
→Số hạt không mang điện = số proton = 67 – 30 = 37 → Chọn B.

Đáp án B
X có số khối A = 67, số proton = số eletron = 18 + 10 + 2 = 30.
→ Số hạt không mang điện = số proton = 67 - 30 = 37 → Chọn B.

Gọi số hạt proton = số hạt electron = p
Số hạt notron = n
Ta có :
$2p + n = 87$
$2p = 1,807n$
Suy ra p = 28 ; n = 31
Vậy, đáp án A thỏa mãn (có đủ 28 hạt electron)
Lưu ý B sai vì không sắp xếp đúng theo lớp electron
A