Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{Fe}=\dfrac{3,36}{56}=0,06\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,06->0,04------->0,02
=> mFe3O4 = 0,02.232 = 4,64 (g)
b) VO2 = 0,04.22,4 = 0,896 (l)

a. \(n_{Fe_3O_4}=\dfrac{6,96}{232}=0,03\left(mol\right)\)
PTHH : 3Fe + 2O2 -to-> Fe3O4
0,09 0,06 0,03
\(m_{Fe}=0,09.56=5,04\left(g\right)\)
\(V_{O_2}=0,06.22,4=1,344\left(l\right)\)
b. PTHH : 2KCl + 3O2 -> 2KClO3
0,06 0,04
\(m_{KClO_3}=0,04.122,5=4,9\left(g\right)\)

a, \(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,3\left(mol\right)\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
b, \(n_{O_2}=2n_{Fe_3O_4}=0,2\left(mol\right)\Rightarrow V_{O_2}=0,2.22,4=4,48\left(l\right)\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,3 0,2 0,1
\(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
\(a,m_{Fe}=0,3.56=16,8\left(g\right)\)
\(b,V_{O_2}=0,2.22,4=4,48\left(l\right)\)

nFe3O4 = 4,64/232 = 0,02 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
Mol: 0,06 <--- 0,04 <--- 0,02
mO2 = 0,04 . 32 = 1,28 (g)

\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,6 0,4 0,2
\(n_{Fe_3O_4}=\dfrac{46,4}{232}=0,2\left(mol\right)\)
\(a,m_{Fe}=0,6.56=33,6\left(g\right)\)
\(b,m_{O_2}=0,4.32=12,8\left(g\right)\)

a, \(n_{Fe_3O_4}=\dfrac{6,96}{232}=0,03\left(mol\right)\)
PTHH: 3Fe + 2O2 ----to----> Fe3O4
Mol: 0,09 0,06 0,03
\(m_{Fe}=0,09.56=5,04\left(g\right)\)
\(m_{O_2}=0,06.32=1,92\left(g\right)\)
b,
PTHH: 2KClO3 ----to---> 2KCl + 3O2
Mol: 0,02 0,06
\(m_{KClO_3}=0,02.122,5=2,45\left(g\right)\)

a, \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, \(2Fe+O_2\rightarrow2FeO\)
c, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
d, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
e, \(2Cu+O_2\underrightarrow{t^o}2CuO\)
f, \(4K+O_2\underrightarrow{t^o}2K_2O\)
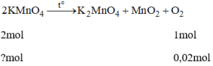
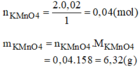
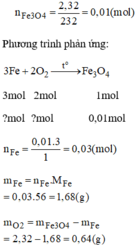
n Fe3O4=\(\dfrac{4,64}{232}=0,02mol\)
3Fe+2O2-to>Fe3O4
0,06----0,04---0,02
=>m O2=0,04.32=1,28g
\(n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,06 0,02 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,06.56=3,36g\)