Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(PTHH:MnO_2+4HCl\rightarrow MnCl_2+2H_2O+Cl_2\)
Đổi 250ml = 0,25l
\(n_{HCl}=4.0,25=1\left(mol\right)\)
\(n_{MnO2}=\frac{17,4}{87}=0,2\left(mol\right)\)
Tỉ lê: \(n_{MnO2}< n_{HCl}\)
Nên MnO2 hết, HCl dư ( Tính nCl2 (lý thuyết) theo nMnO2 )
Số mol MnO2: số mol Cl2= 1:1
\(n_{Cl2}=n_{MnO2}=0,2\left(mol\right)\)
\(m_{Cl2\left(lt\right)}=0,2.71=14,2\left(g\right)\)
\(n_{Cl2\left(tt\right)}=\frac{3,584}{22,4}=0,16\left(mol\right)\)
\(\Rightarrow m_{Cl2\left(tt\right)}=0,16.71=1,36\left(g\right)\)
\(\Rightarrow H=\frac{11,36}{14,2}.100\%=80\%\)

Anh nghĩ 3.65 (g) là khối lượng của HCl luôn ấy em
\(n_{HCl}=\dfrac{3.65}{36.5}=0.1\left(mol\right)\)
\(MnO_2+4HCl_{\left(đ\right)}\rightarrow MnCl_2+Cl_2+2H_2O\)
\(............0.1.............0.025\)
\(V_{Cl_2}=0.025\cdot22.4=0.56\left(l\right)\)

\(n_{KMnO_4}=\frac{15,8}{158}=0,1\left(mol\right)\)
PTHH : \(2KMnO_4+16HCl-->2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(Cl_2+H_2-as->2HCl\) (2)
Có : \(m_{ddHCl}=100\cdot1,05=105\left(g\right)\)
=> \(m_{HCl}=105-97,7=7,3\left(g\right)\)
=> \(n_{HCl}=\frac{7,3}{36,5}=0,2\left(mol\right)\)
BT Clo : \(n_{Cl_2}=\frac{1}{2}n_{HCl}=0,1\left(mol\right)\)
Mà theo lí thuyết : \(n_{Cl_2}=\frac{5}{2}n_{KMnO_4}=0,25\left(mol\right)\)
=> \(H\%=\frac{0,1}{0,25}\cdot100\%=40\%\)
Vì spu nổ thu được hh hai chất khí => \(\hept{\begin{cases}H_2\\HCl\end{cases}}\) (Vì H2 dư)
=> \(n_{hh}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
=> \(n_{H_2\left(spu\right)}=n_{hh}-n_{HCl\left(spu\right)}=0,6-0,2=0,4\left(mol\right)\)
BT Hidro : \(\Sigma_{n_{H2\left(trong.binh\right)}}=n_{H_2\left(spu\right)}+\frac{1}{2}n_{HCl}=0,4+0,1=0,5\left(mol\right)\)
đọc thiếu đề câu a wtf
\(C_{M\left(HCl\right)}=\frac{0,2}{0,1}=2\left(M\right)\)

\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)

MnO\(_2\)+4HCl\(\rightarrow\)MnCl\(_2\)+Cl\(_2\)+2H\(_2O\)
0,45 0,45 (mol)
n\(_{MnO_2}\)=\(\dfrac{39,15}{87}\)=0,45(mol)
2Fe + 3Cl\(_2\)\(\rightarrow\)2FeCl\(_3\)
0,3 0,45 0,3 (mol)
m\(_{FeCl_3}\)=0,3.162,5=48,75(g)
vì hiệu suất phản ứng là 86% nên:
m\(_{FeCl_3}\)=\(\dfrac{86.48,75}{100}\)=41,925(g)
2/
Mg+Cl\(_2\)\(\rightarrow\)MnCl\(_2\)
0,6 0,6
n\(_{Mg}\)=\(\dfrac{14,4}{24}\)=0,6(mol)
2\(KMnO_4+16HCl\rightarrow2MnCl_2+2KCl+5Cl_2\uparrow+8H_2O\)
0,24 0,6
vì hiệu suất phản ứng bằng 80%,nên để điều chế 0,6 mol Cl\(_2\)thì cần số mol \(KMnO_4\) là:
n\(_{KMnO_4}\)=\(\dfrac{0,24.100}{80}\)=0,3(mol)
m\(KMnO_4\)=0,3.158=47,4(g)

\(m_{MnO_2\left(pư\right)}=\dfrac{43,5.85}{100}=36,975\left(g\right)\)
=> \(n_{MnO_2\left(pư\right)}=\dfrac{36,975}{87}=0,425\left(mol\right)\)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,425-------------------->0,425
=> VCl2 = 0,425.22,4 = 9,52 (l)
MnO2 (0,5 mol) + 4HCl \(\xrightarrow[H=85\%]{t^o}\) MnCl2 + Cl2 (0,425 mol) + 2H2O.
Thể tích khí clo thu được (đktc) là 0,425.22,4=9,52 (lít).

\(Đặt:n_{MnO_2}=a\left(mol\right),n_{KMnO_4}=b\left(mol\right)\)
\(m_{hh}=87a+158b=37.96\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(n_{Cl_2}=a+2.5b=0.45\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.4,b=0.02\)
\(\%MnO_2=\dfrac{0.4\cdot87}{37.96}\cdot100\%=91.68\%\\\%KMnO_4=100-91.68=8.32\% \)
\(m_M=m_{KCl}+m_{MnCl_2}=0.02\cdot74.5+\left(0.4+0.02\right)\cdot126=54.41g\)
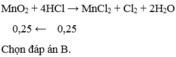
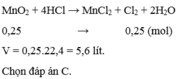
\(n_{MnO_2}=\dfrac{17,4}{87}=0,2\left(mol\right)\\ PTHH:MnO_2+4HCl_{đặc,nóng}\rightarrow MnCl_2+Cl_2+2H_2O\\ n_{Cl_2\left(TT\right)}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\\ n_{Cl_2\left(LT\right)}=n_{MnO_2}=0,2\left(mol\right)\\ \Rightarrow H=\dfrac{n_{Cl_2\left(TT\right)}}{n_{Cl_2\left(LT\right)}}.100\%=\dfrac{0,16}{0,2}.100=80\%\)