Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

Áp dụng ĐLBTKL:
mhh = mX + mY + mCO3 = 10 g; mA = mX + mY + mCl = 10 - mCO3 + mCl.
số mol CO3 = số mol CO2 = 0,03 mol.
Số mol Cl = 2 (số mol Cl2 = số mol CO3) (vì muối X2CO3 tạo ra XCl2, Y2CO3 tạo ra 2YCl3).
Do đó: mA = 10 - 60.0,03 + 71.0,03 = 10,33g.

bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 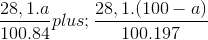 = 0,2
= 0,2
=> a = 29,89.


Đáp án B
Thí nghiệm (1);
Phương trình hóa học :
Fe + CuSO 4 → FeSO 4 + Cu
Cu sinh ra bám vào thanh Fe, do đó hình thành cặp điện cực Fe-Cu nhúng trong dung dịch chất điện li
Thí nghiệm (1) xảy ra hiện tượng ăn mòn điện hóa.
Thí nghiệm (2);
Phương trình hóa học:
Fe + CuSO 4 → FeSO 4 + Cu
Cu sinh ra bám vào thanh Fe, do đó hình thành cặp điện cực Fe-Cu nhúng trong dung dịch chất điện li
Thí nghiệm (1) xảy ra hiện tượng ăn mòn điện hóa.
Thí nghiệm (3), (4) không xảy ra hiện tượng ăn mòn điện hóa vì không có cặp điện cực nhúng trong dung dịch chất điện li:
Fe+Fe2(SO4)3->3FeSO4
3 Fe + 2 O 2 → t ° Fe 3 O 4
Thí nghiệm 4:
Thép (Fe-C) tạo thành cặp cực nhúng trong dung dịch chất điện li (dung dịch NaCl)
Thí nghiệm (4) xảy ra hiện tượng ăn mòn điện hóa