

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Chọn đáp án B
► Xét phần 1: Y + NaOH → H2. Mặt khác, phản ứng xảy ra hoàn toàn ⇒ Al dư.
nAl dư = 0,15 ÷ 1,5 = 0,1 mol. Phần không tan T là Fe ⇒ nFe = nH2 = 0,45 mol.
Lần lượt bảo toàn nguyên tố Oxi và Fe ⇒ nAl2O3 = 0,2 mol.
● GIẢ SỬ phần 1 tác dụng với HCl thì nH2 = 0,1 × 1,5 + 0,45 = 0,6 mol.
||⇒ phần 2 gấp 1,2 ÷ 0,6 = 2 lần phần 1 ⇒ lượng ban đầu gấp 3 lần phần 1.
► m = 3 × (0,1 × 27 + 0,2 × 102 + 0,45 × 56) = 144,9(g) ⇒ chọn B.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 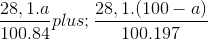 = 0,2
= 0,2
=> a = 29,89.