Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chứng minh được Al dư,
Áp dụng định luật bảo toàn e: Khi Al p.ư với Cr2O3, 3nAlp.ư = 2.3.nCr2O3 → nAlp.ư = 0,06 mol.
Khi Al dư và Al2O3 p.ư với HCl: 3nAl dư + 2nCr = 2nH2 → nAl dư = 0,02 mol.
Vậy tổng số mol Al là 0,08 mol. Sau tất cả các p.ư Al chuyển thành NaAlO2 nên nNaOH = 0,08.

Đáp án D
n C r 2 O 3 = 0 , 03 m o l
Cho toàn bộ X tác dụng với HCl loãng nóng thu được 0,12 mol H2.
Ta thấy 0 , 12 > n C r = 0 , 06 do vậy Al dư
Vậy X chứa Cr 0,06 mol, Al2O3 0,03 mol và Al dư
→ n A l = 0 , 12 - 0 , 06 1 , 5 = 0 , 04 m o l
X tác dụng với lượng dư NaOH
→ n N a O H = 0 , 03 . 2 + 0 , 04 = 0 , 1 m o l

Xét trường hợp Al dư: 2Al + Cr2O3 → 2Cr + Al2O3 (chọn ẩn cho mỗi phần)
2x x
Gọi y là số mol Al dư → 52.2x + 102x + 27y = 46,6:2 ; y + 2x = 0,3 → x = y = 0,1 mol.
Bảo toàn điện tích: nHCl = 6nAl2O3 + 3nAl3+ + 2nCr2+ = 1,3 mol.

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.



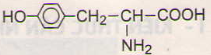 với các chất sau:
với các chất sau:
Đáp án B