
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Trước khi cháy chất parafin ở thể rắn còn khi cháy ở thể hơi Các phân tử parafin phản ứng với các phân tử khí oxi

Vì thể tích 1 mol chất phụ thuộc vào kích thước của phân tử và khoảng cách giữa các phân tử của chất, mà các chất khác nhau thì có phân tử với kích thước và khoảng cách giữa chúng khác nhau.

a) Nước lỏng có thể chảy ra trên khay đựng theo sự phân bố phân tử, ở trạng thái lỏng, các hạt gần nhau và có thể chuyển động trượt lên nhau.
b) Khi chuyển sang thể hơi, số phân tử không đổi nhưng ở thể hơi các phân tử nước chuyển động hỗn độn cách xa nhau nên chiếm thể tích lớn hơn so với thể lỏng.

\(n_{H_2S}=\dfrac{17}{34}=0,5\left(mol\right)\\ V_{H_2S\left(25^oC,1bar\right)}=24,79.0,5=12,395\left(l\right)\)

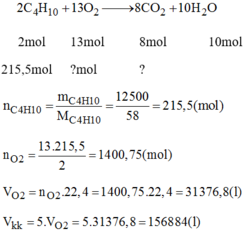
\(n_{C_4H_{10}}=\frac{12500}{58}=215,5\left(mol\right)\)
Phương trình hóa học :
\(2C_4H_{10}+13O_2\rightarrow8CO_2+10H_2O\)
\(2mol\) \(13mol\) \(8mol\)
\(215,5mol\) \(x\) \(mol\rightarrow y\) \(mol\)
a ) \(x=\frac{13\times215,5}{2}=1400,75\left(mol\right)\)
\(V_{kk}=\frac{1400,75\times100\times22,4}{20}=156884\left(lít\right).\)
b ) \(y=\frac{215,5\times8}{2}=862\left(mol\right).\)
\(\rightarrow V_{CO_2}=862\times22,4=19308,8\left(lít\right).\)
Để khong khí trong phòng được thoáng ta cần có máy hút gió trên bếp hoặc mở các của trong bếp ăn .

Nitơ lỏng sôi ở -196 oC, oxi lỏng sôi ở - 183 oC cho nên ta có thể tách riêng hai khí này bằng cách hạ thấp nhiệt độ để hóa lỏng không khí. Hóa lỏng không khí rồi nâng nhiệt độ xuống của không khí đến -196 oC, nitơ lỏng sôi và bay lên trước, còn oxi lỏng đến - 183 oC mới sôi, tách riêng được hai khí.
Đem hóa lỏng hai khí hạ nhiệt độ
Chưng cất ở \(-183^oC\) ta thu được khí oxi, ở \(-196^oC\) ta thu được nitơ
H2O có liên kết Hidro còn H2S thì không có. Liên kết Hidro làm cho các phân tử nước liên kết lại với nhau, nhờ đó, nước ở thể lỏng còn H2S ở thể khí. Còn vì sao có liên kết Hidro thì không nhớ rõ nữa, hình như Oxy có độ âm điện lớn hơn Hidro, hút electron của Hidro về phía mình, do đó, nguyên tử O sẽ tích điện âm, H thiếu e nên tích điện dương. Nhờ vậy, nguyên tử H này lại liên kết với nguyên tử O của phân tử nước khác tạo thành liên kết Hidro.