Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2NaBr + Cl_2 \to 2NaCl + Br_2\\ 2NaI + Cl_2 \to 2NaCl + I_2\\ n_{NaBr} + n_{NaI} = n_{NaCl} = \dfrac{2,94}{58,5} = 0,050256\)

Đáp án A
Đặt: nNaBr = a(mol), nNaI = b(mol)
Ta có các phản ứng
2NaBr + Cl2→ 2NaCl + Br2(1)
a → a
2NaI + Cl2→ 2NaCl + I2(2)
b → b
Từ (1) và (2) => nNaCl = a+b=1,17/58,5 = 0,02 (mol)
nNaBr + nNaI= a+b = 0,02 (mol)

\(2NaBr + Cl_2 \to 2NaCl + Br_2\\ 2NaI + Cl_2 \to 2NaCl + I_2\\ n_{Cl_2} =\dfrac{1}{2}n_{NaCl} = \dfrac{1}{2}.\dfrac{23,4}{58,5} = 0,2(mol)\\ \Rightarrow V_{Cl_2} = 0,2.22,4 = 4,48(lít)\)

\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Cl_2+2NaI\rightarrow2NaCl+I_2\)
Ta có: \(n_{NaCl}=\dfrac{2,8665}{58,5}=0,049\left(mol\right)\)
Theo PT: \(n_{NaCl}=n_{NaBr}+n_{NaI}=0,049\left(mol\right)=x\)
Cho hỗn hợp muối có dạng NaX
PTHH : 2NaX + Cl2 -> 2NaCl + X2
Số mol NaCl \(\dfrac{2,866}{23+35,4}=0,05\left(mol\right)\)
-> molNaX = molNaCl = 0,05 mol

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
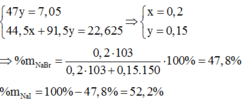

Đặt: nNaBr = a(mol), nNaI = b(mol)
Ta có các phản ứng
2NaBr + Cl2→ 2NaCl + Br2(1)
a → a
2NaI + Cl2→ 2NaCl + I2(2)
b → b
Từ (1) và (2) => nNaCl = a+b=1,17/58,5 = 0,02 (mol)
nNaBr + nNaI= a+b = 0,02 (mol)
\(n_{NaCl}=\frac{m_{NaCl}}{M_{NaCl}}=\frac{5,85}{23+35,5}=0,1\left(mol\right)\)
-> \(n_{\left(Na\right)}=n_{Na}=0,1\left(mol\right)\)
-> \(n_{hh}=0,1\left(mol\right)\)
pt 2NaBr+Cl2-->2NaCl+Br2
2 NaI+Cl2-->2NaCl+I2
nNaCl=5,85\23+35,5=0,1(mol)
-> nhh=0,1(mol)