Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Đốt cháy dây sắt trong oxygen => Tốc độ p.ứ nhanh hơn
b, Sự gỉ sắt trong không khí => Tốc độ p.ứ chậm hơn

a, Tốc độ phản ứng nhanh hơn
b, Tốc độ phản ứng chậm hơn

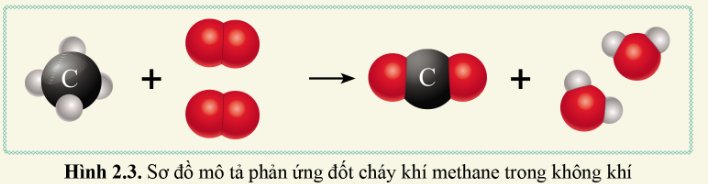
a. Trước phản ứng, có các chất là C, H, O.
- Những nguyên tử H đã liên kết với nguyên tử C, nguyên tử O liên kết với nguyên tử O.
b. Sau phản ứng, có các chất được tào thành là CO2, H2O.
- Những nguyên tử O đã liên kết với nguyên tử C, những nguyên tử H đã liên kết với những nguyên tử O.
c. Số nguyên tử C, H, O trước phản ứng và sau phản ứng đều bằng nhau

a) Phân huỷ đường tạo thành than và nước là phản ứng thu nhiệt.
b) Đốt cháy cồn trong không khí là phản ứng toả nhiệt.

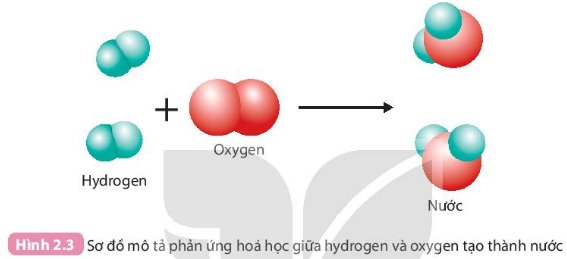
1. Trước và sau phản ứng, những nguyên tử nào liên kết với nhau?
=> những nguyên tử liên kết với nhau là :
+ 2 nguyên tử H liên kết với nhau
+ 2 nguyên tử O liên kết với nhau
2. Trong quá trình phản ứng, số nguyên tử H và số nguyên tử O có thay đổi không?
=> Không thay đổi

- Phản ứng có tốc độ nhanh: Phản ứng đốt cháy khí gas dùng trong đun nấu.
- Phản ứng có tốc độ chậm: Phản ứng lên men giấm, phản ứng địa hình caxto
- Phản ứng có tốc độ nhanh: Phản ứng đốt cháy khí gas dùng trong đun nấu.
- Phản ứng có tốc độ chậm: Phản ứng lên men giấm.

a) Phương trình hoá học của phản ứng:
2Mg + O2 → 2MgO.
b) Phương trình bảo toàn khối lượng của các chất trong phản ứng:
\(m_{Mg}+m_{O_2}=m_{MgO}\)
c) Khối lượng oxygen đã phản ứng là:
\(m_{O_2}=m_{MgO}-m_{Mg}=15-9=6\left(g\right)\)
a: 2Mg+O2 ->2MgO
b: \(m_{Mg}+m_{O_2}=m_{MgO}\)
c; \(m_{O_2}=15-9=6\left(g\right)\)



- Phản ứng sắt bị gỉ xảy ra chậm hơn so với phản ứng đốt cháy cồn.