Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn. Vì vậy, tinh thể nguyên tử đều bền vững, khá cứng, khó nóng chảy, khó bay hơi. Trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy mà tinh thể phân tử dễ nóng chảy, dễ bay hơi.

a) Tinh thể ion: Nacl; MgO; CsBr; CsCl
Tinh thể nguyên tử: Kim cương
Tinh thể phân tử: Băng phiến, iot, nước đá, cacbon đioxit
b) So sánh nhiệt độ nóng chảy:
Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy
– Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyen tử đều bền vững, khá cững, khó nóng chảy, khó bay hơi.
– Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi
c) Không có tinh thể nào có thể dẫn điện ở trạng thái rắn.
Tinh thể dẫn điện được nóng chảy và khi hòa tan trong nước là: tinh thể ion

a) Tinh thể ion: NaCl; KCl, KBr...
Tinh thể nguyên tử: Kim cương
Tinh thể phân tử: Băng phiến, iot, nước đá, cacbon đioxit
b) So sánh nhiệt độ nóng chảy:
Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy
– Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyên tử đều bền vững, khá cứng, khó nóng chảy, khó bay hơi.
– Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi
c) Không có tinh thể nào có thể dẫn điện ở trạng thái rắn.
Tinh thể dẫn điện được nóng chảy và khi hòa tan trong nước là: tinh thể ion

a) Chất có mạng tinh thể nguyên tử: kim cương.
Chất có mạng tinh thể phân tử:ở nhiệt độ thấp thì có khí hiếm, O2, N2,… kết tinh thành tinh thể phân tử.
b) Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn. Vì vậy, tinh thể nguyên tử đều bền vững, khá cứng, khó nóng chảy, khó bay hơi.
Trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy mà tinh thể phân tử dễ nóng chảy, dễ bay hơi.

a)
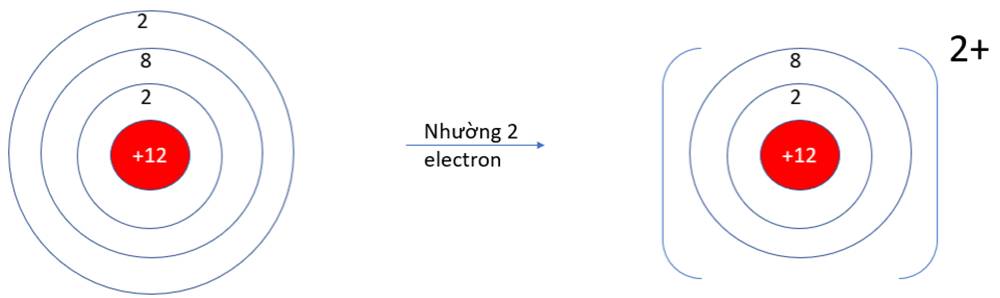
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.

Câu sai là câu C.
Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn.

Đặc điểm hợp chất ion:
+ Các hợp chất ion thường là tinh thể rắn ở điều kiện thường
+ Hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi rất cao
=> Phát biểu (b) và (c) đúng
So sánh nhiệt độ nóng chảy: Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy.
Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyen tử đều bền vững, khá cững, khó nóng chảy, khó bay hơi.
Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi.