Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CTHH: R(NO3)2.xH2O (A)
\(\%m_{NO_3^-}=100\%-42,1875\%-9,375\%=48,4375\%\)
Xét \(\dfrac{m_R}{m_{NO_3^-}}=\dfrac{1.M_R}{2.62}=\dfrac{9,375\%}{48,4375\%}\)
=> MR = 24 (g/mol)
=> R là Mg
(A) có CTHH là Mg(NO3)2.xH2O
Có: \(\%m_{H_2O}=\dfrac{18x}{148+18x}.100\%=42,1875\%\)
=> x = 6
=> CTHH: Mg(NO3)2.6H2O

1/ CTHH dạng TQ là ASO4 . xH2O
*Có : %S/muối tinh thể = \(\dfrac{1.M_S}{M_{ASO4.xH2O}}.100\%=11,51\%\)
=> \(\dfrac{32}{M_{ASO4.xH2O}}=0,1151\)
=> MASO4.xH2O = 278(g)
* Có : %H2O/muối tinh thể = \(\dfrac{x.M_{H2O}}{M_{ASO4.xH2O}}.100\%=45,32\%\)
=> \(\dfrac{x.18}{278}=0,4532\)
=>x= 7
*Lại có : MASO4.xH2O = 278
mà x = 7
=> MA + 96 + 7 .18=278 => MA =56(g) => A là Sắt (Fe)
Vậy CTPT của tinh thể là FeSO4 .7H2O

Ta có :
\(\%H_2O = \dfrac{18n}{M + 62.3 + 18n}.100\% = 40,099\%\\ \Rightarrow M + 62.3 = \dfrac{242}{9}n(1)\\ %N = \dfrac{14.3}{M + 62.3 + 18n}.100\% = 10,4\%\\ \Rightarrow M + 18n = \dfrac{2832}{13}(2)\\ (1)(2)\Rightarrow M = 56(Sắt) ; n = 9\)
CTHH cần tìm : \(Fe(NO_3)_3.9H_2O\)
\(\%H_2O= \dfrac{18n}{M + 62.3+18n}.100\% = 40,099\%\\ \Rightarrow M + 62.3 = \dfrac{242}{9}n(1)\\ \%N = \dfrac{14.3}{M + 62.3 + 18n}.100\% = 10,4\%\\ \Rightarrow M + 18n = \dfrac{2832}{13}(2)\\ (1)(2) \Rightarrow M = 56(Sắt) ; n = 9\\ \)
CTHH cần tìm : \(Fe(NO_3)_3.9H_2O\)

bài này nếu 9h tốiko ai làm thì mk sẽ làm cho nha
chuẩn bị ăn cơm
thôi,làm liều!!!
Gọi CTHH của tinht thể là \(R\left(NO_3\right)_3.nH_2O_{ }\)
ta có %mH2O=40,099%
=> \(\dfrac{18n}{18n+M_R+186}=0,40099\)
Mặt khác %mN= 10,396%
=> \(\dfrac{14.3}{18n+M_R+186}=\dfrac{2599}{25000}\)
=> \(18n+M_R+186\approx404\)
=> \(18n=404.0,40099\approx162=>n=9\)
\(18.9+M_R+186=404=>M_R=56\left(Fe\right)\)
vậy CTHH là \(Fe\left(NO_3\right)_3.9H_2O\)

1/ Gọi hóa trị của R là x
PTHH : 2R + 2xHCl \(\rightarrow\) 2RClx + xH2
a)Đổi 896ml = 0,896(l) , khí B là khí H2
* Có : nH2 = 0,896/22,4 = 0,04(mol)=> mH2 = 0,04 . 2= 0,08(g)
Có : mHCl(ĐB) = \(\dfrac{m_{dd}.C\%}{100\%}=\dfrac{60.7,3\%}{100\%}=4,38\left(g\right)\)
=> nHCl(ĐB) = 4,38/36,5 = 0,12(mol)
Theo PT=> nHCl(Pứ) = 2. nH2 = 2 . 0,04 = 0,08(mol)
mà nHCl(ĐB) = 0,12(mol) > nHCl(Pứ)
=> Sau pứ : HCl dư , kim loại R tan hết
=> Các chất tan trong dd A gồm \(\left\{{}\begin{matrix}RCl_x\\HCl\left(dư\right)\end{matrix}\right.\)
*Theo ĐLBTKL:
mdd sau pứ = mR + mdd HCl - mH2 = 2,24 + 60 - 0,08 = 62,16(g)
* Có : mHCl(pứ) = 0,08 . 36,5 =2,92(g)
Theo ĐLBTKL :
mR + mHCl(Pứ) = mRClx + mH2
=> 2,24 + 2,92 = mRClx + 0,08
=> mRClx = 5,08(g)
=> C%RClx / ddA = \(\dfrac{m_{RClx}}{m_{dd}}.100\%=\dfrac{5,08}{62,16}.100\%=8,17\%\)
* Có : nHCl(dư) = nHCl(ĐB) - nHCl(pứ) = 0,12 - 0,08 = 0,04(mol)
=> mHCl(dư) = 0,04 . 36,5 =1,46(g)
=> C%HCl / ddA = \(\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{1,46}{62,16}.100\%=2,35\%\)
b) Theo PT => nR = 2/x . nH2 = 2/x . 0,04 = 0,08/x (mol)
=> MR = m/n = 2,24 : 0,08/x = 28x(g)
-Biện luận thay x = 1,2,3,...thấy chỉ có x= 2 (thỏa mãn)
=>MR = 28 . 2 = 56(g) => R là kim loại Sắt (Fe)
2/ *Trong MSO4 .xH2O có 12,8%mS
=> %mS/tinh thể = \(\dfrac{1.M_S}{M_{MSO4.xH2O}}.100\%=12,8\%\)
=> \(\dfrac{32}{M_{MSO4.xH2O}}=0,128\Rightarrow M_{MSO4.xH2O}=250\left(g\right)\)
*Lại có :
%mH2O / tinh thể = \(\dfrac{x.M_{H2O}}{M_{MSO4.xH2O}}.100\%=36\%\)
=> \(\dfrac{x.18}{250}=0,36\Rightarrow x=5\)
* Ta có : MMSO4.xH2O = 250(g)
=> MM + 32 + 4.16 + 5.18 = 250
=> MM =64(g) => M là đồng (Cu)
=> CTHH của tinh thể hidrat hóa trên là CuSO4 . 5H2O

*Gọi kim loại hóa trị II là A
PTHH : A + H2SO4 \(\rightarrow\) ASO4 + H2
Có : nH2 = 8,4/22,4 = 0,375(mol)
Theo PT \(\Rightarrow\) nA = nH2 = 0,375(mol)
\(\Rightarrow\) MA = m/n = 21/0,375 = 56 (g)
\(\Rightarrow\) A là kim loại Sắt (Fe)
\(\Rightarrow\) muối sunfat của kim loại đó là FeSO4
*Gọi CTHH dạng TQ của hidrat hóa là FeSO4.xH2O
Theo PT \(\Rightarrow\) nFeSO4 = nH2 = 0,375(mol)
\(\Rightarrow\) nFeSO4.xH2O = 0,375(mol)
\(\Rightarrow\) MFeSO4.xH2O = m/n = 104,25/0,375 = 278 (g)
hay 56 + 32+ 4.16 + x . 18= 278
\(\Rightarrow\) x = 7
Vậy CTHH của hidrat hóa là FeSO4.7H2O

Giải:
Đặt công thức của muối sunfat ngậm nước là:
ASO4. nH2O (n ∈ N*)
Theo bài ra ta có:
Cứ 32g S chiếm 11,51%
Vậy MASO4.nH2O chiếm 100%
=> mASO4. nH2O =\(\dfrac{32.100\%}{11,51}\) = 278 (g) (1)
*Mặt khác ta có:
\(\dfrac{18n}{278}\) = \(\dfrac{45,52}{100}\)
⇔ 18n . 100 = 278 . 45,52
⇔ 18n . 100 = 12654,56
⇔ 18n = 12654,56 : 100
⇔ 18n = 126,5456
⇔ n = 126,5456 : 18
⇔ n = 7 (TMĐK) (2)
Từ (1) và (2) ta có:
MASO4 . 7H2O = NTK(A) + 32 + 16.4 + 7.18 = 278
⇔ NTK(A) + 222 = 278
⇔ NTK(A) = 278 - 222
⇔ NTK(A) = 56 (đvC)
Vậy A là Sắt (Fe)
CT của tinh thể là FeSO4 . 7H2O
Đặt tên công thức ko nhất định phải là MSO4. nH2O mà các bn có thể đặt tên kim loại tùy ý nha

Gọi công thức muối ngậm nước có dạng: RSO 4 . nH 2 O
Theo đề bài ta có hệ phương trình:
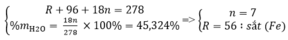
Vậy công thức của muối sắt là: FeSO 4 . 7 H 2 O

Gọi CT của oxit R là RO
PTHH
RO + H2SO4 -> RSO4 + H2O (1)
nH2SO4 = 0,5 mol
Theo (1) nRO = nH2SO4 = 0,5 mol
MRO = 28/ 0,5 = 56 (g/mol)
MR = 40 (g/ mol)
R là Ca
a. CT của oxit là CaO [cái này bạn giải được rồi nên mình k giải lại]
Gọi CT của hidrat là CaSO4.nH2O
Vì số mol của hidrat = số mol của CaSO4= 0,5 mol
M CaSO4.nH2O = 86/0,5 =172 (g/mol)
136 + 18*n = 172
n = 2
CT của hidrat là CaSO4.2H2O
CTHH: R(OH)2.xH2O
\(\%m_{OH}=100\%-24\%-60,88\%=15,12\%\)
Xét \(\dfrac{m_R}{m_{OH}}=\dfrac{60,88\%}{15,12\%}=\dfrac{761}{189}\)
=> \(\dfrac{1.M_R}{2.17}=\dfrac{761}{189}\)
=> MR = 137 (g/mol)
=> R là Ba
=> CTHH: Ba(OH)2.xH2O
Có: \(\%H_2O=\dfrac{18x}{171+18x}.100\%=24\%\)
=> x = 3
=> CTHH: Ba(OH)2.3H2O