Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) nFe3O4= 46,4:232=0,2 mol
PTHH :3Fe+2O2\(\rightarrow\) Fe3O4
0,6 0,4 \(\leftarrow\)0,2 (mol)
PTHH: 2KMnO4\(\rightarrow\) K2MnO4+MnO2+O2
0,8 \(\leftarrow\) 0,4 (mol)
\(\Rightarrow\) m KMnO4= 0,8.158=126,4 g
1) 3Fe + 2O2 ---> Fe3O4 ---> nO2 = 2nFe3O4 = 2.46,4/232 = 0,4 mol.
2KMnO4 ---> K2MnO4 + MnO2 + O2 ---> nKMnO4 = 2nO2 = 0,8 mol
---> mKMnO4 = 158.0,8 = 126,4 g.
2) KClO3 ---> KCl + 3/2O2 ---> nKClO3 = 2/3nO2
---> nKClO3:nKMnO4 = 2/3:2 = 1:3 ---> mKClO3:mKMnO4 = 158/3.122,5 = 0,43
3) KNO3 ---> KNO2 + 1/2O2 ; Cu(NO3)2 ---> CuO + 2NO2 + 1/2O2
Như vậy nếu thu được cùng lượng oxi thì KClO3 sẽ có khối lượng nhỏ nhất.

Trong phòng thí nghiệm, để điều chế oxi, người ta phân hủy 47,4 (g) KMnO4.
a) Tính thể tích khí oxi thu được (đktc).
b) Cho photpho cháy trong oxi thu được ở trên. Tính khối lượng photpho phản ứng và khối lượng sản phẩm thu được?
2KMnO4-to->K2MnO4+MnO2+O2
0,3---------------------------------------0,15
nKMnO4=47,4\158=0,3 mol
=>VO2=0,15.22,4=3,36l
4P+5O2-to->2P2O5
0,12----0,15----0,06
=>mP=0,12.31=3,72g
=>mP2O5=0,06.142=8,52g

\(a,PTHH:2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\\ b,n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ c,4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ n_{P_2O_5}=\dfrac{2}{5}.n_{O_2}=\dfrac{2}{5}.0,05=0,02\left(mol\right)\\ m_{P_2O_5}=0,02.142=2,84\left(g\right)\)

PTHH: 2KMnO4 → K2MnO4 + MnO2 + O2 ↑
Số mol của K2MnO4 là: 78,8 : 197 = 0,4 mol
Số mol của KMnO4 là: 142,2 : 158 = 0,9 mol
So sánh: \(\frac{0,9}{2}>0,4\)
=> KMnO4 chưa được nhiệt phân hết. Tính theo K2MnO4
a) Số mol của MnO2 là: 0,4 mol
Khối lượng MnO2 thu đc là: 0,4 . 87 = 34,8 (gam)
b) Số mol của O2 là: 0,4 mol
Thể tích O2 thu đc là: 0,4 . 22,4 = 8,96 lít
c) Khối lượng O2 thu đc là: 0,4 . 32 = 12,8 gam
pt: 2 KMnO4 ----to--> K2MnO4 + MnO2 + O2
2mol 1mol 1mol 1mol
0,9 mol 0,4 mol
nKMnO4 = 142,2 / 158 = 0,9 mol
nK2MnO4 = 78,8 / 197 = 0,4 mol
Tỉ lệ : \(\frac{0,9}{2}\) > \(\frac{0,4}{1}\)
Vậy n KMnO4 dư nên kê mol các chất còn lại theo n K2MnO4
pt: 2 KMnO4 -----to----> K2MnO4 + MnO2 + O2
2mol 1mol 1mol 1mol
0,8 mol 0,4mol 0,4mol 0,4mol
a) mMnO2= n.M 0,4 . 87 = 34,8 g
b) VO2= n . 22,4 = 0,4 . 22,4 = 8,96 lít
c) mO2 = n.M = 0,4 . 32 = 12,8 g
Chúc bạn học tốt !!!!
![]()

a.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(PTHH:2KMnO_4\underrightarrow{np}K_2MnO_4+MnO_2+O_2\)
2 1 1 1 ( mol )
0,2 0,1
\(V_{O_2}=n.22,4=0,1.22,4=2,24l\)
b.\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
3 2 1 ( mol )
0,2 0,1
0,1 0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n.M=0,05.232=11,6g\)

a. \(n_P=\frac{6,2}{31}=0,2mol\)
\(V_{O_2}=V_{kk}.\frac{1}{5}=\frac{18,48}{5}=3,696l\)
\(n_{O_2}=\frac{3,696}{22,4}=0,165mol\)
PTHH: \(4P+5O_2\xrightarrow{t^o}2P_2O_5\)
Tỷ lệ \(\frac{0,2}{4}>\frac{0,165}{5}\)
Vậy P dư
\(n_{P\left(\text{phản ứng }\right)}=\frac{4}{5}n_{O_2}=0,132mol\)
\(n_{P\left(dư\right)}=0,2-0,132=0,068mol\)
\(\rightarrow m_{P\left(dư\right)}=0,068.31=2,108g\)
b. \(n_{P_2O_5}=\frac{2}{5}n_{O_2}=0,066mol\)
\(\rightarrow m_{P_2O_5}=0,066.142=9,372g\)
c. PTHH: \(2KClO_3\xrightarrow{t^o}2KCl+3O_2\)
\(n_{KClO_3}=\frac{2}{3}n_{O_2}=0,11mol\)
\(\rightarrow m_{KClO_3}=0,11.122,5=13,475g\)

a, PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, Ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,05\left(mol\right)\)
\(\Rightarrow m_{P_2O_5}=0,05.142=7,1\left(g\right)\)
c, Theo PT: \(n_{O_2}=\dfrac{5}{4}n_P=0,125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,125.22,4=2,8\left(l\right)\)
d, Vì: VO2 = 1/5Vkk
\(\Rightarrow V_{kk}=5V_{O_2}=14\left(l\right)\)
Bạn tham khảo nhé!
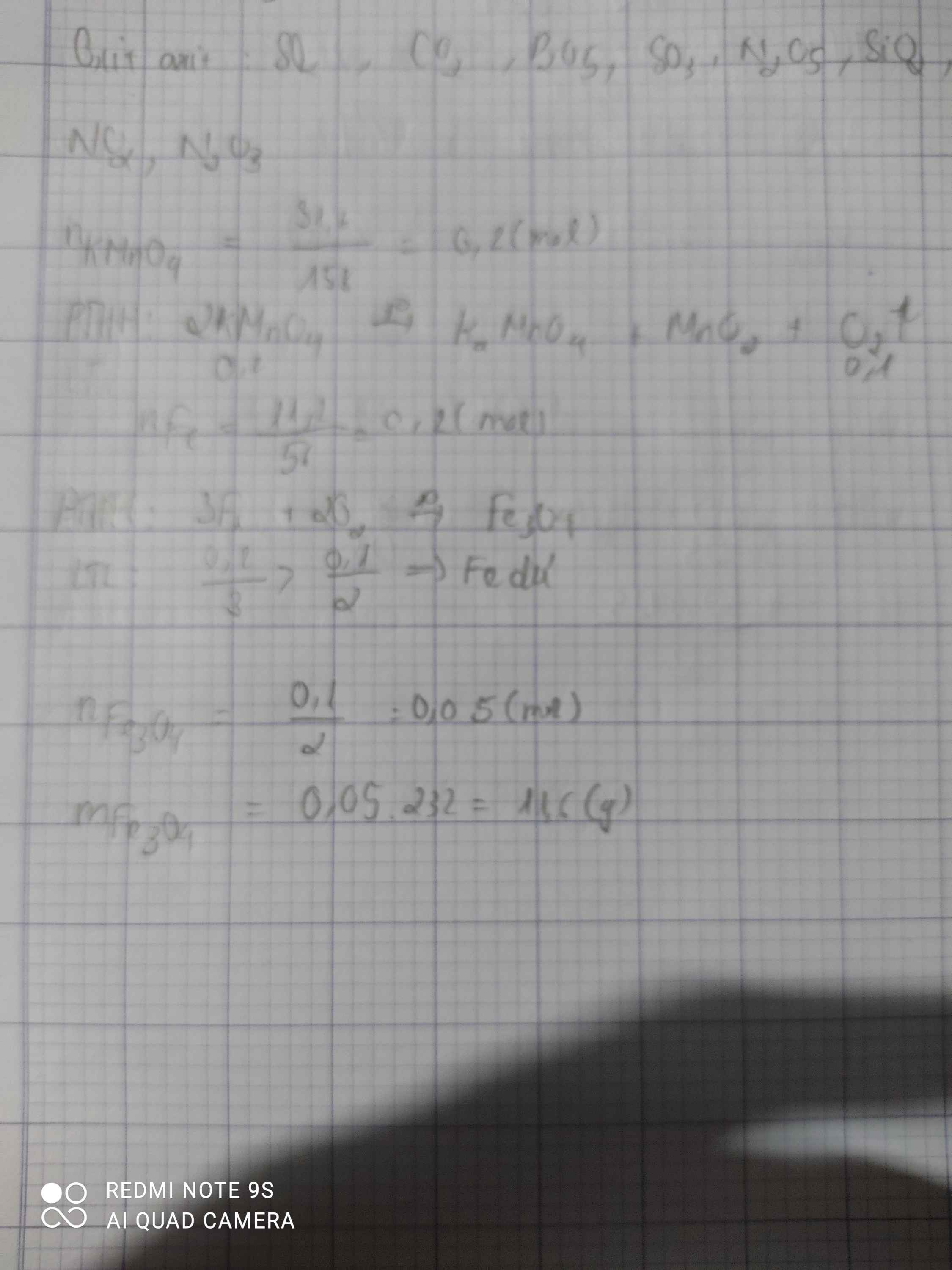

a) nKMnO4= 94,8/158=0,6(mol)
PTHH: 2 KMnO4 -to-> K2MnO4 + MnO2 + O2
0,6_________________0,3______0,3___0,3(mol)
V(O2,đktc)= 0,3.22,4=6,72(l)
b) PTHH: 4 P + 5 O2 -to-> 2 P2O5
nP= 6,4/31= 32/155(mol)
nO2= 0,3(mol)
Ta có : 32/155 :4 < 0,3/5
-> P hết, O2 dư, tính theo nP
mP(p.ứ)= 6,4(g)
nP2O5= 2/4 . nP= 2/4 . 32/155= 16/155(mol)
=> mP2O5= 16/155.142\(\approx14,658\left(g\right)\)