Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
de: 0,1\(\rightarrow\) 0,1 \(\rightarrow\) 0,1 \(\rightarrow\) 0,1 (mol)
\(m_{H_2SO_4}=0,1.98=9,8g\)
a, \(m_{ddH_2SO_4}=\dfrac{9,8}{20}.100=49g\)
b, \(V_{H_2}=22,4.0,1=2,24l\)
c, \(m_{FeSO_4}=0,1.152=15,2g\)
\(m_{ddspu}=49+5,6-2=52,6g\)
\(C\%_{FeSO_4}=\dfrac{15,2}{52,6}.100\%\approx28,9\%\)

Đáp án : C
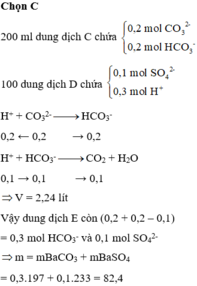
Sau khi trộn thì trong dung dịch có : 0,2 mol HCO3- và 0,2 molCO32-
D có : nH+ = 0,3 mol ; 0,1 mol SO42-
Khi nhỏ từ từ D và thì thứ tự phản ứng là :
CO32- + H+ -> HCO3-
HCO3- + H+ -> CO2 + H2O
=> Còn lại : 0,3 mol HCO3‑ ; 0,1 mol SO42-
Phản ứng với Ba(OH)2 => kết tủa gồm : 0,3 mol BaCO3 và 0,1 mol BaSO4
=> m = 82,4g
VCO2 = 0,1 mol = 2,24 lit

Chọn đáp án D
(a) Cho Na vào dung dịch CuSO4. Có Cu(OH)2
(b) Cho Ba vào dung dịch H2SO4. Có BaSO4
(c) Cho dung dịch NH3 dư vào dung dịch AlCl3. Có Al(OH)3
(d) Cho dung dịch NaOH vào dung dịch H2SO4 loãng. Không có
(e) Cho bột Fe vào dung dịch FeCl3 dư. Không có

Đáp án : D
Trong A :
n H + = 2 n H 2 S O 4 + n H N O 3 + n H C l = 0,21 mol
Trong B :
n O H - = nNaOH + nKOH = 0,49V mol
Để C có pH = 2 (axit) => H+ dư
=> nH+(C) = 10-pH .(0,3 + V) = 0,21 – 0,49V
=> V = 0,414 lit


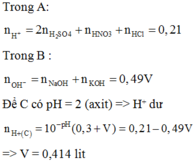
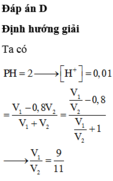
sử dụng quy tắc đường chéo ( ở đây ko có chức năng nối nên mình ko nối vào cho bạn thấy rõ được)
15% < C% < 30% ( * )
200g dd H2SO4 15% 30% - C%
C%
300g dd H2SO4 30% C% - 15%
200/300 = 2/3 = ( 30 - C ) / ( C - 15 ) <=> 2C - 30= 90 - 3C
<=> 5C = 120
<=> C = 24 (%) ( thỏa mãn * )