Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1/ Trong M có Z1, N1; Trong X có Z2, N2
Ta có:
Z1 + 2Z2 = 58 (1)
N1 - Z1 = 4 (2)
Z2 = N2 (3)
Vì M chiếm 46.67% => (Z1 + N1)/(Z2 + N2) = 46.67/ 53.33 (4)
Thay 2,3 vào 4 => (2Z1 + 4)/2Z2 = 46.67/53.33
Giải hệ pt là ra.
2/ Trong X có Z1, N1; Y có Z2, N2.
Ta có:
2Z1 + N1 + 3( 2Z2 + N2) = 120
=> 2Z1 + N1 + 6Z2 + 3N2 = 120 (1)
2Z1 + 6Z2 - N1 - 3N2 = 40 (2)
Từ 1 + 2 --> Z1 + 3Z2 = 40
Lấy 1 - 2 --> N1 + 3N2 = 40
Vậy M của hợp chất là 80

Đáp án C
Tổng số hạt proton, notron, electron trong hai nguyên tử kim loại A, B là 142
→ 2pA +nA + 2pB +nB = 142
Số hạt mang điện nhiều hơn số hạt không mang điện là 42
→ 2pA + 2pB - (nA+ +nB) = 12
Giải hệ → 2pA +2pB =92 , nA+ +nB= 50
Số hạt mang điện của nguyên tử B nhiều hơn của A là 12
→ 2pB - 2pA = 12
Giải hệ → pA = 20 (Ca), pB = 26 (Fe)

Số hạt proton trung bình là $30 : 2 = 15$
Mặt khác B có số proton nhiều hơn A, suy ra :
+) Số proton của A là 14 ; số proton của B là 16
Suy ra A là Nito ; B là Lưu huỳnh
Mà A và B tạo với nhau hợp chất $AB_3 \Rightarrow $ loại
+) Số proton của A là 13 ; số proton của B là 17
Suy ra A là Al ; B là Clo
PTPU điều chế : $2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3$

Tổng số proton trong MX2 là 58 hạt → ZM + 2.ZX = 58
Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt → -ZM + NM = 4
Trong hạt nhân X, số notron bằng số proton → ZX = NX
MA =ZM + NM + 2.ZX + 2.NX = (ZM + 2.ZX ) + NM + 2NX= 58 + NM + 58 - ZM = 116 + NM- ZM
M chiếm 46,67% về khối lượng → ZM + NM =
7
15
. (116 + NM- ZM ) → 22ZM + 8NM = 812
Ta có hệ
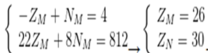
M là Fe
→ ZX =
58
-
26
2
= 16 → X là S
Công thức của A là FeS2.
Đáp án A.

Đáp án A
Tổng số proton trong MX2 là 58 hạt → ZM + 2.ZX = 58
Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt → -ZM + NM = 4
Trong hạt nhân X, số notron bằng số proton → ZX = NX
MA =ZM + NM + 2.ZX + 2.NX = (ZM + 2.ZX ) + NM + 2NX
= 58 + NM + 58 - ZM = 116 + NM - ZM
M chiếm 46,67% về khối lượng
![]()
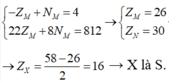
=> M là Fe
Gọi \(x;y\) là số proton trong hạt nhân \(A,B\)
Theo giả thiết : \(x+3y+2=42\leftrightarrow y=\frac{40-x}{3};\) hay \(y< \frac{40}{3}=13,3\)
Vì \(B\) là phi kim ( tạo anion ) và có \(Z< 13,3\) nên \(B\) là \(F,O,N\)
\(A\) có \(Z=13\leftrightarrow A\) là \(Al\)
Công thức anion \(AB\frac{2-}{3}\) là \(AlF\frac{2-}{3}\leftrightarrow Al^++3F^-\) , vô lí không có \(Al^+\)
Nếu B là O ( Z = 8 ) \(\rightarrow x=42-2-3.8=16\)
A có \(Z=16\rightarrow A\) là S . Công thức anion \(SO\frac{2-}{3}\) ( phù hợp )
Nếu B là N ( Z = 7 ) . Công thức ainon \(KN\frac{2-}{3}\rightarrow K^{7+}+3N^{3-}\) vô lí .
Vậy A : S số khối là \(16.2=32,B\) là O số khối là \(8.2=16\)
Gọi x và y là số proton trong các hạt nhân hay số electron ở lớp vỏ nguyên tử AA và BB tương ứng.
Ta có: x+3y=42−2=40x+3y=42−2=40. Như vậy y<40/3=13,33y<40/3=13,33. B thuộc chu kì 22 và là một phi kim (tạo anion) nên B chỉ có thể là flo, oxi hoặc nitơ.
Khi B là flo thì y=9,AF−3y=9,AF3− và A có số oxi hóa bằng +1+1 và x=40−3×9=13x=40−3×9=13. Trường hợp này loại vì nhôm không có số oxi hóa bằng