Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

áp dụng công thức
v = ΔC\Δt = 0,22 - 0,1 \ 4 = 0,03 (M\s)�‾=Δ�Δ�=0,22−0,14=0,03(��)

1. Bình được bổ sung chất xúc tác có tốc độ thoát khí nhanh hơn so với bình không có chất xúc tác.
2. Khi có chất xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó số hạt có đủ năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.

a) HCl + PbO2 → PbCl2 + Cl2 + H2O
H+Cl- + Pb4+O22- → Pb2+Cl2- + Cl20 + H2+O2-
1 x 1 x | 2Cl- → Cl20 + 2e Pb4+ + 2e → Pb2+ |
⇒ 2Cl- + Pb4+ → Pb2+ + Cl20
2HCl + PbO2 → PbCl2 + Cl2 + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K+Mn7+O42- + H+Cl- → K+Cl- + Mn2+Cl2- + Cl20 + H2+O2-
5 x 2 x | 2Cl- → Cl20 + 2e Mn7+ + 5e → Mn2+ |
⇒ 10Cl- + 2Mn7+ → 2Mn2+ + 5Cl20
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O

4.MnO2+4HCl\(\rightarrow\)MnCl2+Cl2+2H2O
Mn+4 +2e \(\rightarrow\)Mn+2
2Cl- \(\rightarrow\)Cl2+2e
5.2KMnO4+16HCl\(\rightarrow\)2KCl+2MnCl2+5Cl2+8H2O
Mn+7+5e\(\rightarrow\)Mn+2
2Cl-\(\rightarrow\)Cl2+2e
6.8FeO+26HNO3\(\rightarrow\)8Fe(NO3)3+N2O+13H2O
Fe+2\(\rightarrow\)Fe+3 +1e
2N+5+8e\(\rightarrow\)2N+1
7.2KMnO4+3K2SO3+H2O\(\rightarrow\)3K2SO4+2MnO2+2KOH
S+4\(\rightarrow\)S+6 +2e
Mn+7+3e\(\rightarrow\)Mn+4
8.\(\text{2KMnO4+10FeSO4+8H2SO4}\rightarrow\text{5Fe2(SO4)3+2MnSO4+K2SO4+8H2O}\)
Mn+7 +5e\(\rightarrow\)Mn+2
Fe+2 \(\rightarrow\)Fe+3+1e
2KMnO4\(\rightarrow\)K2MnO4+O2+MnO2

bạn cho nhiều vậy ai lm cho nổi ; thôi mk làm 1 câu khó nhất bn nhờ vào đó lm các câu còn lại nha .
câu 6) ta có : \(K\overset{+7}{Mn}O_4\overset{ }{+}\overset{+2}{Fe}SO_4\overset{ }{+}\overset{ }{H_2SO_4}\overset{ }{\rightarrow}\overset{+3}{Fe}_2\left(SO_4\right)_3\overset{ }{+}\overset{ }{\overset{+2}{Mn}SO_4}\overset{ }{+}\overset{ }{K_2SO_4}\overset{ }{+}\overset{ }{H_2O}\)
\(\Rightarrow\overset{+7}{Mn}\overset{ }{+}\overset{ }{5e}\overset{ }{\rightarrow}\overset{+2}{Mn}\) ; \(\overset{+2}{Fe}\overset{ }{\rightarrow}\overset{+3}{Fe}\overset{ }{+}\overset{ }{e}\) \(\Rightarrow\) hệ số giữa \(Mn\) và \(Fe\) là \(1\backslash5\)
trong đó chất khử là \(FeSO_4\) chất OXH là \(KMnO_4\) và chất môi trường là \(H_2SO_4\)
\(\Rightarrow2K\overset{+7}{Mn}O_4\overset{ }{+}10\overset{+2}{Fe}SO_4\overset{ }{+}8\overset{ }{H_2SO_4}\overset{ }{\rightarrow}5\overset{+3}{Fe}_2\left(SO_4\right)_3\overset{ }{+}2\overset{ }{\overset{+2}{Mn}SO_4}\overset{ }{+}\overset{ }{K_2SO_4}\overset{ }{+}8\overset{ }{H_2O}\)
câu 6) ta có : K+7MnO4++2FeSO4+H2SO4→+3Fe2(SO4)3++2MnSO4+K2SO4+H2OKMn+7O4+Fe+2SO4+H2SO4→Fe+32(SO4)3+Mn+2SO4+K2SO4+H2O
⇒+7Mn+5e→+2Mn⇒Mn+7+5e→Mn+2 ; +2Fe→+3Fe+eFe+2→Fe+3+e ⇒⇒ hệ số giữa MnMn và FeFe là 1∖51∖5
trong đó chất khử là FeSO4FeSO4 chất OXH là KMnO4KMnO4 và chất môi trường là H2SO4H2SO4
⇒2K+7MnO4+10+2FeSO4+8H2SO4→5+3Fe2(SO4)3+2+2MnSO4+K2SO4+8H2O
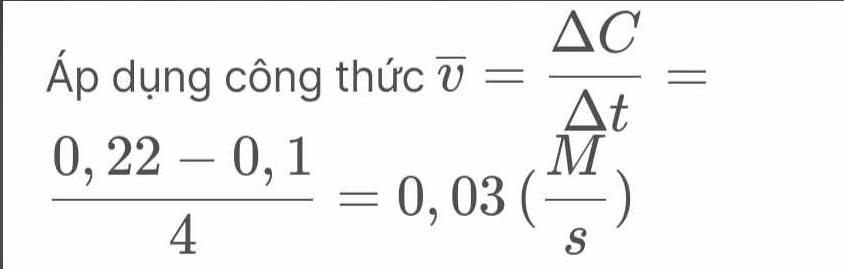
HCl là chất oxi hóa nên số oxi hóa của nó giảm
=> Đáp án D
Quá trình oxi hóa:
H+1 + 1e ----> H0