Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n C u S O 4 = 0,5.0,2 = 0,1 mol
2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
2x……3x……..x……3x (Mol)
Theo bài ta có:
m C u b á m v à o - m A l tan = m A l t ă n g
⇔ 3x.64 - 2x.27 = 25,69 - 25
⇔ 138x = 0,69
⇔ x = 0,005 mol
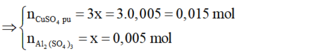

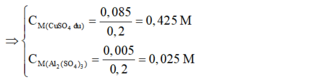
⇒ Chọn D.

Al: 25 gam + 0,1 mol CuSO4 → thanh nhôm nặng 25,69 gam.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Sau phản ứng mtăng = 25,69 - 25 = 0,69 gam
=> \(n_{Al} = 2. \dfrac{0,69}{3 .64 - 2 . 27} = 0,01 mol\)
=> nAl2(SO4)3 = 0,005 mol; nCuSO4dư = 0,1 - 0,015 = 0,085 mol
=> CM Al2(SO4)3= 0,025 M; CM CuSO4 = 0,425 M

Bài 1 : Cách 1 :
Gọi x là số mol của Fe pư với CuSO4
Theo đề bài ta có :
\(Fe+C\text{uS}O4->FeSO4+Cu\)
xmol.....xmol................................xmol
Ta có :
\(\Delta m\left(t\text{ă}ng\right)=m_{kl-sau}-m_{kl-tr\text{ư}\text{ớc}}\)
<=> 64x - 56x = 1,6
<=> 8x = 1,6 => x = 0,2(mol)
=> nCuSO4 = 0,2 mol => CMCuSO4 = \(\dfrac{0,2}{0,2}=1\left(M\right)\)
Cách 2 :
Gọi x là khối lượng của Fe tham gia pư :
Ta có PTHH :
\(Fe+C\text{uS}O4->FeSO4+Cu\)
56g.......160g..............................64g
xg..........\(\dfrac{160x}{56}g\) .......................\(\dfrac{64x}{56}g\)
Ta có : \(\dfrac{64x}{56}-x=1,6\)
<=> \(\dfrac{8}{7}x-x=1,6< =>\dfrac{1}{7}x=1,6=>x=11,2\left(g\right)=>nFe\left(p\text{ư}\right)=\dfrac{11,2}{56}=0,2\left(mol\right)=nCuSO4=0,2\left(mol\right)=>CM_{C\text{uS}O4}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Bài 2 :
Gọi x là số mol của Al tham gia pư
PTHH :
2Al + 3CuSO4 \(\rightarrow\) Al2(SO4)3 + 3Cu
xmol...........................................3/2xmol
Ta có :
\(\Delta m\left(t\text{ă}ng\right)=46,38-45=1,38\left(g\right)\)
<=> 96x - 27x = 1,38
<=> x = 0,02 (mol)
=> mCu = 0,02.64 = 1,28(g)
Vậy...

2Al + 3CuSO4 = Al2(SO4)3 + 3Cu.
Cứ 54 gam nhôm phản ứng tạo ra 192 gam Cu làm khối lượng thanh nhôm tăng lên 138 gam.
Khối lượng thanh nhôm của bạn chỉ tăng 1,38 gam tức là chỉ có 1,92 gam đồng thoát ra.

Trần Hữu Tuyển Nguyễn Thị Minh Thương Phùng Hà Châu Nguyễn Thị Kiều Nguyễn Anh Thư Gia Hân Ngô Cẩm Vân Nguyễn Thị giúp với !

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
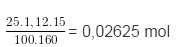
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:


Gọi x là số mol Zn p.ứ
Zn + CuSO4 = ZnSO4 + Cu
x x x (mol)
Vì khi phản ứng Zn tác dụng với CuSO4 và Cu bám trên bề mặt lá kẽm nên sau phản ứng ta thu được 49,82g khối lượng chất rắn gồm Zn dư và Cu
Ta có: 65x - 64x = 50 - 49,82 = 0,18(g)
=> x = 0,18 (mol)
Khối lượng CuSO4 trong dung dịch là
0,18 x 160 = 28,8 (g)
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\\ Đặt:n_{Al\left(pứ\right)}=x\left(mol\right)\\ m_{tăng}=m_{Cu\left(sinhra\right)}-m_{Al\left(pứ\right)}=\dfrac{3}{2}x.64-x.27=25,69-25\\ \Rightarrow x=0,01\left(mol\right)\\ \Rightarrow n_{CuSO_4\left(dư\right)}=0,2.0,5-0,01.\dfrac{3}{2}=0,085\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=0,01\left(mol\right)\\ CM_{Al_2\left(SO_4\right)_3}=\dfrac{0,01}{0,2}=0,05\left(M\right)\\ CM_{CuSO_4\left(dư\right)}=\dfrac{0,085}{0,2}=0,475M\)
nCuSO4= 0,5.0,2 = 0,1 mol
2Al+3CuSO4→Al2(SO4)3+3Cu
2x……3x……..x……3x (Mol)
Theo bài ta có:
mCu bámvào−mAl tan=mAl tăng
⇔ 3x.64 - 2x.27 = 25,69 - 25
⇔ 138x = 0,69
⇔ x = 0,005 mol
*Tham khảo