Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất

Coi như cho cả X và H2SO4 cùng lúc vào dd kiềm (vừa đủ) thì kết quả sinh ra vẫn là muối và nước. Dung dịch sau cùng chưa các ion: \(H_2N-C_xH_y-\left(COO\right)^{2-};K^+;Na^+;SO_4^{2-}.\)
Có ngay: \(n_{H^+}=n_{OH^-}=2n_X+2n_{H_2SO_4}=0,4\left(mol\right)\)
Mà \(n_{K+}=3n_{Na+}\Rightarrow n_{K+}=0,3\left(mol\right);n_{Na+}=0,1\left(mol\right)\)
\(m_{H_2N-C_xH_y-\left(COO\right)^{2-}}=m_{muối}-m_{K+}-m_{Na+}-m_{SO_4^{2-}} \\ =36,7-0,3\cdot39-0,1\cdot23-0,1\cdot96=13,1\left(gam\right)\)
\(M_{H_2N-C_xH_y-\left(COO\right)^{2-}}=\frac{13,1}{0,1}=131\\ \Rightarrow M_X=131+2=133\\ \Rightarrow\%N=\frac{14}{133}\cdot100\%\approx10,526\%\)
cho m gam axit glutamicvaof dung dịch NAOH thu được dd X chứa 23,1 gam chất tan . để tác dụng vừa đủ với chất tantrong X cần dùng 200ml dung dịch HCL 1M và H2S4O 0,5M thu được dung dịch chứa 38,4 gam hỗn hợp muối .m=?

Bảo toàn Na: mol NaOH=2*mol Na2CO3 = 0.06
Bảo toàn khối lượng ==> mH2O = 2,76 + 40*0,06 - 4,44 = 0,72 ==> mol H2O = 0,04
CxHyOz + NaOH ---> muối CxHy-1O2Na + H2O (1)
----a--------0,06----------------------------------0,04
muối CxHy-1O2Na + O2 ----> CO2 + H2O + Na2CO3 (2)
------------------------------------0,11---0,05-----0,03
(1)+(2): CxHyO2Na + NaOH + O2 ----> CO2 + H2O + Na2CO3 (2)
-----------------a------------------------------0,11---0,09-----0,03
mol H: ay + 0,06 = 2*0.09 = 0,18 ===> ay = 0,12
Khi A cháy ==> mol H2O = 0,5ay = 0,06 ==> m H2O = 1,08
Theo bài ra, thu được 4,44g 2 muối + nước
\(\Rightarrow\) 2 x 76 + 0,06 x 40 = 4,44 + m(g) nước
A = CxHyO2
nC = 0,14mol; nH = 0,1 + 0,04 − 0,06 = 0,08
nO = \(\frac{2\times76-m_C-m_H}{16}\) = 0,06
\(\Rightarrow\) Công thức phân tử: C7H6O3.
Đốt cháy thu \(n_{H_2O}\) = 0,02 x 3 = 0,06 mol \(\Rightarrow\) \(m_{H_2O}\) = 0,06 x 18 = 1,08 gam.

Coi như hỗn hợp X chỉ gồm Na, K, Ba, O
Cho X vào nước thì 3 kim loại phản ứng sinh ra khí H2, còn O tác dụng với H2 để tạo ra nước theo tỷ lệ 1Oxi+1H2
\(\Rightarrow\) \(n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_O=0,14\left(mol\right)\)
Có \(n_{Na}=n_{NaOH}=0,18\left(mol\right)\)
\(n_K=n_{KOH}=\frac{0,044m}{56};n_{Ba}=n_{Ba\left(OH\right)_2}=\frac{0,93m}{171}\left(mol\right)\)
\(\Rightarrow n_O=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_{H_2}=0,09+\frac{0,022m}{56}+\frac{0,465m}{171}\)
Lại có phương trình tổng khối lượng hỗn hợp X:
\(m_X=m=m_{Na}+m_K+m_{Ba}+m_O\\ =0,18.23+\frac{0,044m}{56}.39+\frac{0,93m}{171}.137+m_O\)
Thay số mol Oxi tính được (theo m) ở trên vào ta được phương trình 1 ẩn m
giải ra được \(m\approx25,5\)

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

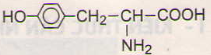 với các chất sau:
với các chất sau:
n(Na2CO3) = 0,2 → nmuối = 0,4
2 CnH2nO2NNa + (3n – 1,5) O2 → Na2CO3 + (2n – 1) CO2 + 2n H2O + N2
n(CO2) = 0,2(2n – 1)
n(H2O) = 0,4n
m(CO2) + m(H2O) = 65,6 → n = 3
→ m(CnH2nO2Nna) = 44,4 gam
n(O2) = 1,5
Bảo toàn khối lượng cho phản ứng thủy phân E:
m(E) + 40.0,4 = 44,4 + 0,1.18 → m(E) = 30,2
Đốt 30,2 gam E cần 1,5 mol O2
→ Đốt 1,51.44,4 gam E cần 3,33 mol O2
→ Đáp án C