Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sơ đồ quá trình điều chế
(C6H10O5)n + nH2O → nC6H 12O6 (1)
C6H12O6 → 2C2H5OH + 2CO2 (k) (2)
Khối lượng tinh bột là: .106 =2.105 gam
Từ phương trình (1) và (2) ta có khối lượng rượu etylic thu được là
.n.2.46 =113580,24 gam
Hiệu suất quá trình là :
H= .100=70%

B1
==>A
Vì lượng HNO3 hao hụt 20% nên hiệu suất phản ứng chỉ đạt 80%. Gọi x là số kg HNO3 đem phản ứng thì lượng HNO3 phản ứng là x.80% kg.
Phương trình phản ứng :
Theo (1) và giả thiết ta thấy khối lượng HNO3 nguyên chất đã tham gia phản ứng là :
Thể tích dung dịch HNO3 nguyên chất cần dùng là :
B2==>A
*tk

mC2H4 thực tế : \(4.0,7=2,8\)tan
\(C_2H_4\rightarrow-\left(CH_2-CH_2\right)-\)
28 28
\(2,8\) \(\rightarrow\) \(2,8\)
mPE thực tế =\(2,8.0,9=2,52\)
\(\rightarrow C\)

\(\begin{cases}C_2H_6:0.2mol\\C_3H_{8:}:0.8mol\end{cases}\)=> M=41.2=>\(\begin{cases}Y\\H_2\end{cases}\)(M=27)
phản ứng đè H2 chọn số mol trước phản ứng n1=1mol
n2là số mol sau pư:
\(\frac{n_1}{n_2}=\frac{M_2}{M_1}\)=> \(n_2=\frac{M_1.n_1}{M_2}=1,5259mol\)
=> nH2=n2-n1=0.5259 mol
=> H=\(\frac{0.5259}{1}.100\)=52.59%
=> A

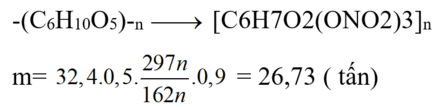
Chọn đáp án C
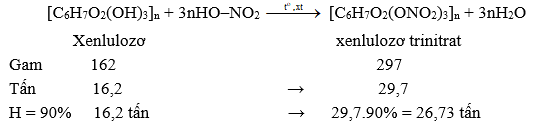
[C6H7O2(OH)3]n + 3nHNO3 → H 2 S O 4 , t o [C6H7O2(ONO2)3]n + 3nH2O.
nxenlulozơ = 32,4 × 0,5 ÷ 162 = 0,1 mol ⇒ m = 0,1 × 0,9 × 297 = 26,73(g) ⇒ chọn C.