
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Fe + 2HCl -> FeCl2 + H2 (1)
b) nFe = \(\dfrac{5,6}{56}\) = 0,1(mol)
So sánh tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\) => HCl dư, bài toán tính theo Fe
Theo PT (1) ta có: n\(H_2\) = nFe = 0,1(mol)
=> V\(H_2\) = 0,1.22,4 = 2,24(l)
c) Theo PT (1) ta có: n\(FeCl_2\) = nFe = 0,1(mol)

Bài 1:
a) Số mol kẽm là:
nZn = m/M = 32,5/65 = 0,5 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2↑
--------0,5-----1-------0,5---------0,5--
b) Thể tích H2 ở đktc là:
VH2 = 22,4.n = 22,4.0,5 = 11,2 (l)
c) Khối lượng ZnCl2 tạo thành:
mZnCl2 = n.M = 0,5.136 = 68 (g)
Vậy ...
Bài toán 1: Cho 32,5 gam kẽm tác dụng với dung dịch axit clohiđric dư.
a) Viết PTHH.
b) Tính thể tích khí hiđro sinh ra (đktc)
c) Tính khối lượng lượng muối kẽm clorua tạo thành ?
giải:
a, PTHH: Zn + 2HCl->ZnCl2+H2
Ta có nZn=32,5/65=0,5mol
Theo PTHH ta có nH2=nZn=0,5mol
=>VH2=0,5.22,4=11,2l
c,Theo PTHH ta có nZnCl2=nH2=0,5mol
=>mZnCl2=0,5.136=68g
Cho mik 1 tick đúng nha, đề dài quá nên mình ko làm hết

câu 5:
2Al + 6HCl -> 2AlCl3 + 3H2
4P + 5O2 -> 2P2O5
Fe3O4+ 4H2 -> 3Fe + 4H2O
BaO + H2O -> BaOH
Câu 6:
Trích mẫu thử
Cho nước vào các mẫu thử
tan=>P2O5,Na2O
Không tan=>MgO
pt:P2O5+3H2O--->2H3PO4
Na2O+H2O--->2NaOH
Cho quỳ tím vào
Quỳ tím chuyển thành màu xanh=>NaOH
_____________________đỏ=>H3PO4

Hoàn thành là phải cân bằng, bài 1 có 2 PT đầu chưa cân bằng , Bài 2 cũng có những PT chưa cân bằng
a)4 Al + 3O2 -to->....2Al2O3
b) C2H6+ 7\2O2 -to->2CO2+3H2O
c) Au + O22 --> ....ko pư
d)4 Na + O2 -to-> ...2Na2O
e) Ag + O2O2 --> ...ko pư
2. Bổ túc và phân loại phản ứng (Hóa hợp hay phân hủy)
a)2K+2HCl .-->2 KCl + ....H2
b) ..4.P+5O2. -to->2 P2O5 .......
c) S + O2 -to-> .....SO2
d) C2H6O + 7\2O2 -to-> ...2.CO2+3H2O

fe+H2SO4->FeSO4+H2
1: 1: 1: :1
0,2->0,2->0,2->0,2(mol)
nFe=m:M=11,2:56=0,2(mol)
vH2=n.22,4=0,2.22,4=4,48(l)
mFeSO4=n.M=0,2.(56+32=16.4)=30,4(g)
PTPU
Fe+ H2SO4\(\rightarrow\) FeSO4+ H2
0,2...................0,2........0,2...
ta có: nFe= 11,2/ 56= 0,2( mol)
\(\Rightarrow\) VH2= 0,2. 22,4= 4,48( lít)
mFeSO4= 0,2. 152= 30,4( g)

Tham khảo :
PTHH :
Fe3O4 + 4CO -----> 3Fe + 4CO2
Fe3O4 + 4H2 -----> 3Fe + 4H2O
Phản ứng đủ
Theo Định luật BTKL ta có :
mFe3O4 + mhh (khí) - mCO2 - mH2O = mFe
=> 139,2 + 36 - 74,4 = mFe
=> 100,8 (g) = mFe
Vậy khối lượng sắt thu được sau phản ứng là 100,8 (g)
Tham khảo:
m_Fe=m=139,2+36-74,4=100,8 gam

Câu 1: Tổng số hạt cơ bản (p, n, e) trong nguyên tử nguyên tố X là 46, biết số hạt mang điện nhiều hơn số hạt không mang điện là 14. Xác định chu kì, số hiệu nguyên tử của X trong bảng tuần hoàn.
A. Chu kì 2, ô 7 B. Chu kì 3 ô 17
C. Chu kì 3 ô 16 D. Chu kì 3, ô 15
Câu 2: Tính chất phi kim của các nguyên tố trong dãy N - P - As - Sb - Bi (nhóm VA) biến đổi theo chiều:
A. Tăng B. Không thay đổi
C. Vừa giảm vừa tăng. D. Giảm
Câu 3: Cho các phân tử N2, HCl, NaCl, MgO. Các phân tử đều có liên kết cộng hóa trị là
A. NaCl và MgO B. HCl và MgO
C. N2 và NaCl D. N2 và HCl
Câu 4: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. ion. B. Cộng hoá trị.
C. Kim loại. D. Cho nhận
Câu 5: Cho biết cấu hình electron của nguyên tố A là 1s22s22p63s23p4 và cấu hình electron của nguyên tố B là 1s22s22p63s1. Phát biểu đúng là
A. Nguyên tố A là KL, nguyên tố B là PK
B. Nguyên tố A là PK, nguyên tố B là KL.
C. Nguyên tố A, nguyên tố B đều là PK
D. Nguyên tố A, nguyên tố B đều là KL.
Câu 6: Hợp chất của một nguyên tố có công thức RH2. Oxit cao nhất của R chiếm 40% khối lượng R. R là:
A. N (M = 14) B. Se (M = 79).
C. S (M = 32) D. Ca (M = 40)
Câu 7: Cho phương trình phản ứng hóa học sau:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O. Trong phản ứng trên chất khử là:
A. Fe B. HNO3
C. Fe(NO3)3 D. N2O
Câu 8: Nguyên tố X có Z = 20. Vị trí của X trong hệ thống hoàn:
A. Tất cả đều sai
B. Chu kì 3, nhóm IA
C. Chu kì 4, nhóm IIA
D. Chu kì 4, nhóm IIIA.
Câu 9: Trong các phân tử sau, phân tử có liên kết ba giữa hai nguyên tử là:
A. Khí flo. B. Khí cacbonic.
C. Khí hyđrô. D. Khí nitơ.
Câu 10: Số oxi hóa của lưu huỳnh trong các phân tử và ion sau: SO42-, H2SO4, H2SO3 lần lượt là
A. -2, +4, +6. B. +6, +4, +6.
C. +6, +6, +4. D. +4, +6, +6.
Câu 11: Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxy hóa khử.
A. Fe + 2HCl → FeCl2
B. Fe + CuSO4 → FeSO4 + Cu.
C. 2FeCl3 + Fe → 3FeCl3
D. FeS + 2HCl → FeCl2 + H2S
Câu 12: Trong phản ứng hoá học sau: 3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O. Cl2đóng vai trò là gì?
A. Chỉ là chất oxi hoá
B. Vừa là chất oxi hoá, vừa là chất khử
C. Chỉ là chất khử.
D. Không phải là chất oxi hoá, không phải là chất khử

a. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
b. 2KClO3→ 2KCl + 3O2
c. CH4 + 2O2→ CO2 +2H2O
d. CuO + H2 → Cu +H2O

a)
n Fe2O3=8/(56✖ 2+16❌ 3)=0.05mol
b)nH2=6.72/22.4=0.3mol
c) nH2=9.1023/6.1023=1.5mol
VH2=1,5✖ 22.4=33.6l
d)nO2=3,2/32=0,1mol
➡ nN2=0,4mol
mN2=0,4✖ 28=11,2g
e)nFe2(SO4)3=8/400=0,02mol
f)nH2=(1,2✖ 10^23)/6✖ 10^23=0,2mol
nN2=2,8/28=0,1mol
VN2=0,1✖ 22,4=2,24l
VO2=1,5✖ 22,4=33,6l
VH2=0,1 ✖ 22,4=2,24l
VX=2,24+2,24+33,6=38.08l
mO2=1,5❌ 32=48g
mN2=0,1✖ 28=2,8g
mH2=0,1✖ 2=0,2g
mX=2,8+0,2+48=51g

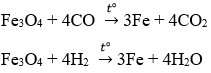
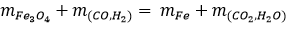
Dùng nam châm hút đc vụn sắt
Còn lại là nhôm
Bởi vì nam châm chỉ hút được sắt nên chúng ta dùng năm châm hút vụn sắt ra khỏi hỗn hợp còn lại vụn đồng thì chúng ta sẽ tách được vụn sắt và vụn đồng ra khỏi hỗn hợp vụn sắt và vụn đồng