Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khí CO 2 khẳng định bằng dung dịch Ca OH 2
CaCO 3 → CaO + CO 2
Ca OH 2 + CO 2 → CaCO 3 + H 2 O

Khí H 2 cháy trong không khí kèm theo tiếng nổ nhỏ.
H 2 SO 4 + Zn → Zn SO 4 + H 2
H 2 + 1/2 O 2 → H 2 O

Khí SO 2 khí này làm mất màu dung dịch KMn O 4
2 H 2 SO 4 + Cu → CuS O 4 + SO 2 + 2 H 2
2 H 2 O + 2KMn O 4 + 5 SO 2 → 2 H 2 SO 4 + 2MnS O 4 + K 2 SO 4
(không màu) (tím) (không màu, mùi sốc) (không màu) (trắng)

Khí Cl 2 khí clo ẩm có tính tẩy màu.
4HCl + MnO 2 → Mn Cl 2 + Cl 2 + 2 H 2 O

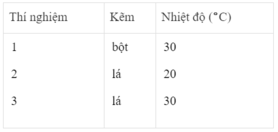
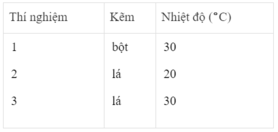
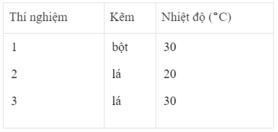
Thể tích khí hiđro :
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H 2 SO 4 tham gia phản ứng
n H 2 = n H 2 SO 4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
V H 2 = 0,1 x 24 = 2,4l = 2400 cm 3
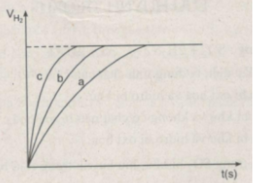
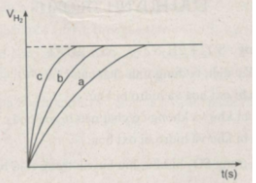
Ta ghi số 2400 cm 3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!

Điều chế MgCl2 bằng:
- Phản ứng hóa hợp: Mg + Cl2 → MgCl2
- Phản ứng thế: Mg + CuCl2 → MgCl2 + Cu
- Phản ứng trao đổi: Mg(OH)2 + 2HCl → MgCl2 + 2H2O
HT

Nhận xét:
- Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với H 2 SO 4 ở thí nghiệm 1 lớn hơn. trong khi đó nhiệt độ của dung dịch axit là như nhau.
- Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch H 2 SO 4 ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau.

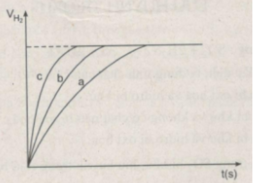
Đồ thị biểu diễn các phản ứng :
Đường cong c biểu diễn cho thí nghiệm 1, phản ứng xảy ra nhanh nhất
Đường cong b biểu diễn cho thí nghiệm 3, phản ứng xảy ra nhanh trung bình.
Đường cong a biểu diễn cho thí nghiệm 2, phản ứng xảy ra chậm nhất.
Khí O 2 khí này làm than hồng bùng cháy.
2KMn O 4 → K 2 Mn O 4 + O 2 + Mn O 2