Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

SO 2 2 SO 2 + 2 H 2 O + O 2 → 2 H 2 SO 4 2 H 2 S + SO 2 → 2 H 2 O + 3 S

Cu Br 2
Cu Br 2 là chất oxi hóa
Cu Br 2 + Fe → Fe Br 2 + Cu
Cu Br 2 là chất khử
Cu Br 2 + Cl 2 → Cu Cl 2 + Br 2

Các chất có thể đóng vai trò chất oxi hoá là S, SO 2 , H 2 SO 3 . Thí dụ
a) S + 2Na → Na 2 S
b) SO 2 + 2 H 2 S → 3S + 2 H 2 O
c) H 2 SO 3 + 2 H 2 S → t ° 3S + 3 H 2 O
Các chất có thể đóng vai trò chất khử là S, H 2 S , SO 2 , H 2 SO 3 . Thí dụ
a) S + O 2 → t ° SO 2
b) H 2 S + Cl 2 → S + 2HCl
c) SO 2 + Br 2 + 2 H 2 O → H 2 SO 4 + 2HBr
d) 5 H 2 SO 3 + 2 KMnO 4 → 2 H 2 SO 4 + K 2 SO 4 + 2Mn SO 4 + 3 H 2 O

$a\bigg)$
$Cl_2+H_2O\leftrightharpoons HCl+HClO$
$CH_4+Cl_2\xrightarrow{ánh\, sáng}CH_3Cl+HCl$
$CH_3Cl+Cl_2\xrightarrow{ánh\, sáng}CH_2Cl_2+HCl$
$CH_2Cl_2+Cl_2\xrightarrow{ánh\, sáng}CHCl_3+HCl$
$CHCl_3+Cl_2\xrightarrow{ánh\, sáng}CCl_4+HCl$
$b\bigg)$
- Chất khử:
$2KMnO_4+16HCl\to 2KCl+2MnCl_2+5Cl_2+8H_2O$
- Chất oxi hóa:
$Fe+2HCl\to FeCl_2+H_2$
- Chất trao đổi:
$AgNO_3+HCl\to AgCl\downarrow+NaNO_3$

Những cặp chất xảy ra phản ứng oxi hoá - khử :
(1)
(2) MnO2 + 4HCl > MnCl2 + Cl2 + 2H2O
b) Trong phản ứng (1) :
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hoá nguyên tử hiđro.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2) :
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hoá ion clo.
- Ion Mn nhận electron là chất oxi hoá. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.

a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 → BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
2H2SO4 + 2KBr → Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 → 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng
a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 \(\rightarrow\) BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 \(\rightarrow\) BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu \(\rightarrow\) CuSO4 + SO2 + 2H2O
2H2SO4 + S \(\rightarrow\) 3SO2 + 2H2O
2H2SO4 + 2KBr \(\rightarrow\) Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 \(\rightarrow\) 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.
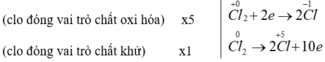
HCl 2 HCl + Fe → FeCl 2 + H 2 4 HCl + MnO 2 → MnCl 2 + Cl 2 + 2 H 2 O