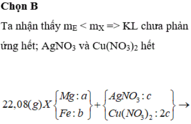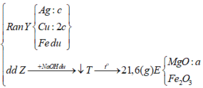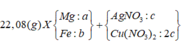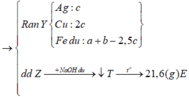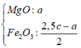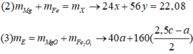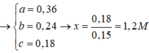Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nHCl = nCl- = 2nO = (23,2 - 16,8).2 : 18 = 0,8-> V = 400ml
=> Đáp án A

Chọn đáp án B
Ø Chia, tách nhỏ từng bài tập, quá trình ra để giải:
¨ chỉ có Al + NaOH → NaAlO2 + 3/2H2/uparrow || nNaOH = nH2 = 0,12 mol
⇒ chứng tử sau phản ứng NaOH còn dư 0,04 mol và ∑nAl trong A = 0,08 mol.
Khí B như ta biết gồm CO2 (sinh ra do FeCO3) và H2 (do Fe)
10 gam kết tủa là 0,1 mol CaCO3 ⇒ có 0,1 mol CO2 ⇒ nFeCO3 = 0,1 mol.
Rắn R ra chắc chắn có Cu và có thể là còn dư kim loại Fe. Vậy phần trong dung dịch?
À, gồm: 0,08 mol AlCl3; 0,12 mol NaCl + ??? mol FeCl2. Mà ∑nHCl = nHCl = 0,74 mol
⇒ bảo toàn Cl có ngay nFeCl2 = 0,19 mol; sinh ra do 0,1 mol FeCO3 ⇒ còn 0,09 nữa do Fe.
Vậy mR = mCu, Fe lọc ra = 20 – mAl – mFeCO3 – mFe phản ứng = 1,2 gam.
R gồm Cu, Fe là các kim loại hoạt động TB yếu nên + HNO3 sinh NO hoặc NO2.
ở đây dùng HNO3 đặc nên khí duy nhất sinh ra là NO2 || nNO2 = 0,05 mol
⇒ bảo toàn electron có 3nFe + 2nCu = nNO2 = 0,05 mol mà mFe + Cu = 1,2 gam
⇒ giải ra nFe = nCu = 0,01 mol. Đọc tiếp quá trình cuối
⇒ m gam sản phẩm gồm 0,01 mol CuO và 0,05 mol Fe2O3 ⇒ m = 1,6 gam → chọn đáp án B