Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

Giả sử số hiệu nguyên tử và số nơtron trong nguyên tử R lần lượt là Z, N.
Ta có hpt:
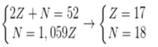
R có 17 electron, 17 proton và 18 nơtron
Số hạt mang điện nhiều hơn số hạt không mang điện là 2Z - N = 2 x 17 - 18 = 16.
R có số khối là A = 17 + 18 = 35.
Điện tích hạt nhân của R là 17+.
→ Chọn D.

Đáp án D.
Tổng số các loại hạt proton, nơtron và electron của R là 52
p + n + e = 52 => 2p + n = 52 (1)
Tổng số hạt không mang điện gấp 1,059 số hạt mang điện âm
n = 1,059.e hay n -1,059p = 0 (2)
Từ (1), (2) ta có p = e =17 , n =18
Số khối của R = 35.

Cái nguyên tử X mình làm ko ra bạn xem lại đề cái 53,125 nếu là 53,125% thì bạn giải ra đươc p = 16 và n = 17 đó là lưu huỳnh ( ra nghiệm đẹp mình nghĩ là đúng )
Ta có 2p + n = 8 và n = 52,63/100 . ( p + n ) từ hệ trên bạn giải ra p = 9 và n = 10 đó là Flo

Giả sử: Số proton, nơtron, electron của R lần lượt là: P, N, E
⇒ Số electron của R+ là: E - 1
⇒ P + N + E - 1 = 57
⇒ 2P + N = 58 (1)
Mà: Trong nguyên tử R, số hạt mang điện nhiều hơn số hạt không mang điện là 18 hạt.
⇒ 2P - N = 18 (2)
Từ (1) và (2) ⇒ P = E = 19 (hạt); N = 20 (hạt)
⇒ Số electron của R+ là: E - 1 = 19 - 1 = 18 (hạt)
Bạn tham khảo nhé!

Đáp án D.
Tổng số các loại hạt proton, nơtron và electron của R là 52
P + n + e = 52 2p + n = 52 (1)
Tổng số hạt không mang điện gấp 1,059 số hạt mang điện âm
n = 1,059.e hay n -1,059p = 0 (2)
Từ (1), (2) ta có p = e =17 , n =18
R là Clo, thuộc nhóm VIIA. Số oxi hóa cao nhất là +7

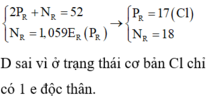
Đáp án D
D sai vì ở trạng thái cơ bản Cl chỉ có 1 e độc thân
Chọn D