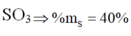Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Công thức hợp chất khí là X H 2
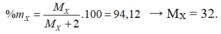
Vậy X là lưu huỳnh (S).
Công thức oxit cao nhất là S O 3
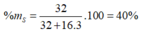

Đáp án D
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4: Lớp ngoài cùng có 6e
X thuộc nhóm VIA
Hợp chất khí với Hidro của X là: H2X
X chiếm 94,12% khối lượng:
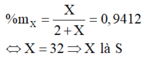
Công thức Oxit cao nhất là SO3
![]()

Đáp án D
X: ns2np4 → X thuộc nhóm IVA → hợp chất khí với H là XH2 → oxit cao nhất là XO3
Ta có: ![]() → MX = 32 (đvC)
→ MX = 32 (đvC)
→ %X trong oxit cao nhất = ![]() .100% = 40%
.100% = 40%

Đáp án D
X có cấu hình electron lớp ngoài cùng là ns2np4 → hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có
![]() .100% = 94,12% → X= 32 → X là Lưu huỳnh
.100% = 94,12% → X= 32 → X là Lưu huỳnh
Oxit cao nhất của S là SO3 → %S = ![]() .100% = 40%
.100% = 40%

Đáp án D
Hướng dẫn X có cấu hình electron lớp ngoài cùng là ns2np4 → hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có
![]() → X= 32 → X là Lưu huỳnh
→ X= 32 → X là Lưu huỳnh
Oxit cao nhất của S là SO3 → ![]()

RH4 -> RO2
%R= 53,3% => %O = 100-53,3= 46,7%
\(\dfrac{R}{53,3}\)=\(\dfrac{32}{46,7}\)
giải tìm R

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.

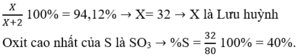
Đáp án D
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4: Lớp ngoài cùng có 6e
⇒ X thuộc nhóm VIA
Hợp chất khí với Hidro của X là: H2X
X chiếm 94,12% khối lượng:
Công thức Oxit cao nhất là